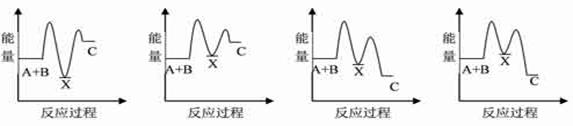
题目内容
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化,但不一定有能量变化 |
| B.CaO+H2O=Ca(OH)2是放热反应,说明CaO 的能量大于Ca(OH)2的能量 |
| C.Ba(OH)2·8H2O晶体与氯化铵晶体反应不需加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
D
解析试题分析:A.化学反应的过程就是原子重新组合的过程,所以一定有物质变化,但在反应的过程中要断裂化学键,形成新的化学键,所以一定有能量变化。错误。B.CaO+H2O=Ca(OH)2是放热反应,说明CaO 和水的总的能量大于生成物Ca(OH)2的能量。错误。C.Ba(OH)2·8H2O晶体与氯化铵晶体反应是吸热反应。但是反应在一定条件下进行,反应的条件比一定是加热。错误。D.由H2→2H的过程就是断裂化学键形成单个的原子的过程,需要吸收能量。正确。
考点:考查化学反应与能量的说法的知识。

 阅读快车系列答案
阅读快车系列答案下列变化为放热的化学反应的是 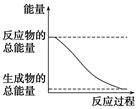
| A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1 |
| C.形成化学键时共放出862 kJ能量的化学反应 |
| D.能量变化如右图所示的化学反应 |
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g) ===2H2O(g) ΔH=-Q2 ②
H2O(g) ===H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为 ( )
| A.4Q1+0.5Q2+9Q3 | B.4Q1+0.5Q2 | C.4Q1+Q2+10Q3 | D.4Q1+2Q2 |
已知H—H键能为436 kJ·mol-1,N—H键能为391 kJ·mol-1,根据化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
| A.431 kJ·mol-1 | B.946 kJ·mol-1 |
| C.649 kJ·mol-1 | D.896 kJ·mol-1 |
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
| A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
| B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1 SO2(g) △H<-Q kJ·mol-1 |
| D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
根据碘与氢气反应的热化学方程式
(1) I2(g)+ H2(g) 2HI(g) △H = -9.48 kJ/mol
2HI(g) △H = -9.48 kJ/mol
(2) I2(S)+ H2(g) 2HI(g) △H = +26.48 kJ/mol
2HI(g) △H = +26.48 kJ/mol
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
| A.浓硫酸与水 | B.生石灰与水 | C.熟石灰与水 | D.氯化钠与水 |
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |