题目内容
5.在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4;⑤NH3能使溶液的导电能力增强的是( )| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ②③④ |
分析 H2S具有还原性,能被强氧化剂氧化;H2S是弱酸,属于弱电解质,其水溶液导电性较弱,与氨气反应生成强电解质,增强了溶液导电性;H2S能和硫酸铜反应生成难溶于稀硫酸的CuS,据此分析解答.
解答 解:H2S具有还原性,能被强氧化剂氧化,
①2H2S+O2=S↓+2H2O,该反应由酸性变为中性,溶液中离子浓度减小,导电性减弱,故①错误;
②H2S+Cl2=S↓+2HCl,氢硫酸属于弱电解质,HCl属于强酸,所以反应后溶液中氢离子浓度增大,则溶液导电性增强,故②正确;
③2H2S+SO2=3S↓+2H2O,溶液由酸性变为中性,溶液中离子浓度减小,导电性减弱,故③错误;
④H2S+CuSO4=CuS↓+H2SO4,氢硫酸属于弱电解质,硫酸是强电解质,所以反应后溶液中氢离子浓度增大,则溶液导电性增强,故④正确;
⑤硫化氢为弱电解质,导电性较弱,氨气与硫化氢反应生成强电解质氯化铵,溶液导电性增强,故⑤正确;
故选B.
点评 本题考查了氢硫酸的性质、溶液导电性强弱判断,题目难度中等,注意掌握硫化氢的化学性质,明确影响溶液导电性强弱的因素,④为易错点,注意CuS不溶于硫酸.

练习册系列答案
相关题目
15.容量瓶上标有的是:①温度、②浓度、③容量、④质量、⑤刻度线、⑥密度,其中正确的是( )
| A. | ①③⑤ | B. | ③⑤⑥ | C. | ①⑤⑥ | D. | ②③⑤ |
13.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| C. | 0.5mol/LAlCl3溶液中Cl-的数目为2NA | |
| D. | 17g氨气中含有的电子数为10NA |
20.1molC2H4和Cl2完全加成,再与Cl2光照条件下发生取代反应,所有氢原子被氯原子取代,则共消耗Cl2的物质的量是( )
| A. | 6mol | B. | 5mol | C. | 4mol | D. | 3mol |
10.如图与对应的叙述一定正确的是( )


| A. | ①所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | ②表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂 | |
| C. | ③所示,t1℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2℃时,两种溶液中溶质的质量分数不再相等 | |
| D. | ④所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
17.下列说法正确的是( )
| A. | 自来水中通入Cl2用于杀菌、消毒是利用HClO的性质 | |
| B. | 用氯气消毒过的水可用于配制澄清石灰水溶液 | |
| C. | 氯水、液氯、氯气的成分相同,Cl2和Cl-的化学性质也相同 | |
| D. | 久制的氯水呈无色,但仍然有漂白、杀菌的功能 |
14.下列各组离子一定能大量共存的是( )
| A. | 25℃,由水电离出的c(H+)=10-11mol/L的溶液:Na+、K+、Cl-、ClO- | |
| B. | 与Al反应能放出氢气的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 甲基橙变红的溶液:Na+、Mg2+、SO42-、Cl- | |
| D. | 含Al3+的溶液:K+、Ca2+、Cl-、S2- |
15.下列实验方法或操作能达到实验目的是( )


| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
 .
.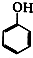 +NaOH→
+NaOH→ +H2O.
+H2O. .
. $\stackrel{酸性KMnO_{4}溶液}{→}$CO2.
$\stackrel{酸性KMnO_{4}溶液}{→}$CO2.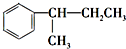 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.