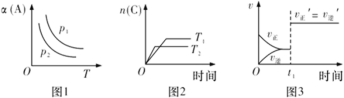
题目内容
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
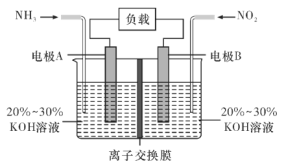
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:______________________________,负极反应方程式:____________________________。
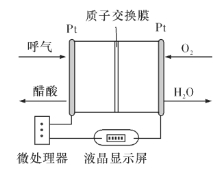
【答案】右 左 阴 2NH3-6e-+6OH-=N2+6H2O 0.8mol C2H5OH+O2=CH3COOH+H2O C2H5OH+H2O-4e-=CH3COOH+4H+
【解析】
(1)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,放电时电流由正极经过导线流向负极;
(2)根据离子交换膜的作用分析判断;
(3)NH3在负极失电子的氧化反应,结合碱性条件、守恒思想写出电极反应式;
(4)正极上NO2发生得电子的还原反应,电极反应式为2NO2+8e-+4H2O=N2+8OH-,据此计算;
(5)由图2可知,酒精发生氧化反应生成醋酸,氧气得电子生成水,即酒精和氧气反应生成醋酸和水,所以左侧Pt电极为负极、右侧Pt电极为正极,据此写出总化学方程式和电极反应式。
由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极;
(1)原电池放电时,电流由正极经过导线流向负极,即电流由右侧电极经过负载后流向左侧电极;
(2)原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作;
(3)A电极为负极,发生失电子的氧化反应,反应式为电解质溶液呈碱性,则负极电极方程式为2NH3-6e-+6OH-=N2+6H2O;
(4)正极上NO2发生的电极反应式为2NO2+8e-+4H2O=N2+8OH-,即有2molNO2被处理时,转移电子8mol,所以有4.48LNO2(标准状况)即0.2molNO2被处理时,转移电子0.8mol;
(5)由图2可知,酒精和氧气反应生成醋酸和水,化学方程式为C2H5OH+O2=CH3COOH+H2O,酒精发生氧化反应生成醋酸,所以生成醋酸的Pt电极为负极,电极反应式为C2H5OH+H2O-4e-=CH3COOH+4H+。

 阅读快车系列答案
阅读快车系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验I:将Fe3+转化为Fe2+
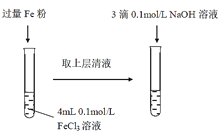
(1)常温下,FeCl3溶液显酸性,用离子方程式表示其显酸性的原因___。
(2)Fe3+与Fe粉发生反应的离子方程式为___。
(3)滴加NaOH溶液观察到的现象为___。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(4)用离子方程式解释NO产生的原因___。
(5)从化学反应限度的角度对体系中存在的反应进行反应I:Fe2+与HNO3反应;反应II:Fe2+与NO反应
①乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是___。
②查阅资料反应I的速率比反应II慢,请用化学平衡移动原理解释溶液由棕色变为黄色的原因___。
(6)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请画出实验装置图,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。___
Fe3+的转化,同时避免出现此异常现象。___