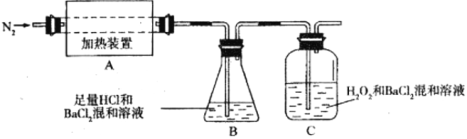
题目内容
【题目】下列实验的实验操作、实验现象和实验结论都正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 室温下,向铝箔上滴加浓硫酸 | 无明显现象 | 铝与浓硫酸不反应 |
B | 将二氧化硫通入紫色石蕊试液 | 先变红后褪色 | 二氧化硫是酸性氧化物,还具有漂白性 |
C | 在氯化银悬浊液中滴加少量KBr稀溶液 | 白色浑浊变为淡黄色浑浊 | Ksp(AgCl)>Ksp (AgBr) |
D | NaAlO2溶液中滴加 NaHCO3溶液 | 产生白色沉淀 | N aAlO2和Na HCO3发生相互促进的水解反应 |
A. A B. B C. C D. D
【答案】C
【解析】
A. 室温下,铝与浓硫酸发生钝化;
B. 二氧化硫通入紫色石蕊试液,溶液会变红,但不会褪色;
C. 难溶沉淀转化为更难溶的沉淀,发生沉淀的转化;
D. AlO2-促进 HCO3-的电离,生成白色沉淀;
A.铝与浓硫酸发生钝化,阻止反应的进一步发生,观察不到明显现象,但发生了氧化还原反应,故A项错误;
B. 二氧化硫是酸性氧化物,可以使紫色石蕊试液变红,但二氧化硫只能使品红溶液褪色,不能使紫色石蕊试液褪色,则现象和结论不正确,故B项错误;
C. AgBr比AgCl难溶,当在氯化银悬浊液中滴加少量KBr稀溶液,会发生反应AgCl(s)+Br- ![]() AgBr(s)+Cl-,则白色浑浊变为淡黄色浑浊,相同类型的难溶物,其溶解度越小,对应的Ksp越小,所以实验操作、实验现象和实验结论都正确,故C项正确;
AgBr(s)+Cl-,则白色浑浊变为淡黄色浑浊,相同类型的难溶物,其溶解度越小,对应的Ksp越小,所以实验操作、实验现象和实验结论都正确,故C项正确;
D. NaAlO2溶液中滴加 NaHCO3溶液,发生反应:AlO2-+HCO3-+H2O = Al(OH)3↓+ CO32-,所以AlO2-促进了HCO3-的电离,跟HCO3-的水解无关,则结论错误,故D项错误;
答案选C。

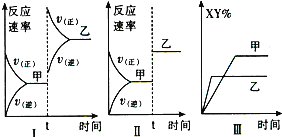
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |