题目内容
【题目】硫酸工业尾气中的SOj是常见的大气污染物,可通过以下几种方式变废为宝:
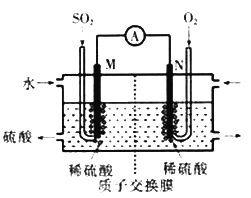
(1)电化学处理法:硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料)写出N极发生的电极反应式________________________;溶液中的阳离子向______极(M或N)移动,标准状况下,当有22.4LSO2参加反应时,溶液中有________mol阳离子向该极移动。
(2)钠碱循环法:用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1mol/L的Na2SO3溶液中,①当溶液的PH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______________。
②当溶液的PH降至约为6时,需送至电解槽再生,再生示意图如下:
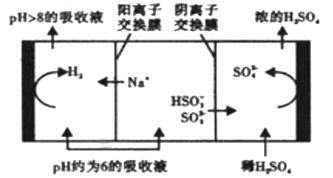
HSO3-在阳极放电的电极反应式是______________________________。
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:___________。
【答案】 O2+4H++4e- ==2H2O N 2 c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) HSO3-+H2O-2e- ==SO42-+3H+ 或SO32-+H2O-2e- ==SO42-+2H+ H+在阴极得电子生成H2,溶液中C(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,使吸收液再生
【解析】(1)N电极通入氧气,是原电池的正极,电解质溶液显酸性,则N极发生的电极反应式为O2+4H++4e-==2H2O;溶液中的阳离子向正极,即向N极(M或N)移动;标准状况下,当有22.4LSO2即1mol二氧化硫参加反应时转移2mol电子,根据电荷守恒可知溶液中有2mol阳离子向该极移动。(2)①当溶液的pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,说明大部分转化为亚硫酸氢钠,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)。②HSO3-在阳极发生失去电子的氧化反应,则放电的电极反应式是HSO3-+H2O-2e-==SO42-+3H+。由于H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,从而使吸收液再生。

 名校课堂系列答案
名校课堂系列答案