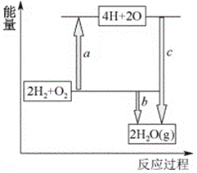
题目内容
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: 
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
【答案】
(1)0.1mol
(2)0.1mol?L﹣1
【解析】解:(1)根据MgCl2的物质的量浓度=镁离子浓度=0.5 molL﹣1 , MgCl2的物质的量=0.5 molL﹣1×0.2L=0.1mol,故答案为:0.1mol;(2)溶液中的电荷守恒:c(Na+)×1+c(Mg2+)×2+c(Ca2+)×2=c(Cl﹣)×1,1.0 molL﹣1 +0.5 molL﹣1×2+c(Ca2+)×2=3 molL﹣1×1,c(Ca2+)=0.5 molL﹣1 , c(CaCl2)=0.5 molL﹣1 , 稀释后溶液中Ca2+的物质的量浓度为 ![]() =0.1 molL﹣1 , 故答案为:0.1mol;0.1 molL﹣1 . (1)先根据MgCl2的物质的量浓度=镁离子浓度来计算浓度,再根据n=cV计算;(2)根据稀释前后溶质的物质的量不变,利用C=
=0.1 molL﹣1 , 故答案为:0.1mol;0.1 molL﹣1 . (1)先根据MgCl2的物质的量浓度=镁离子浓度来计算浓度,再根据n=cV计算;(2)根据稀释前后溶质的物质的量不变,利用C= ![]() 来解答.
来解答.

练习册系列答案
相关题目