题目内容
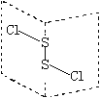
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程________.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________,其与水反应的化学方程式为________.
(4)F分子中含有6个原子,其化学式是________或________.
【答案】 K Cl S ![]() →
→ ![]() F2 2F2+2H2O=4HF+O2 N2H4 CH4O
F2 2F2+2H2O=4HF+O2 N2H4 CH4O
【解析】![]() 微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去
微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去![]() 的对应离子;二是第四周期的金属阳离子;三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子
的对应离子;二是第四周期的金属阳离子;三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子![]() 、
、![]() ;阴离子
;阴离子![]() 、
、![]() 、
、![]() 、
、![]() ;分子有Ar、HCl、
;分子有Ar、HCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等。
等。
(1)含有![]() 的
的![]() 、
、![]() 、
、![]() 分别为
分别为![]() 、
、![]() 、
、![]() ,所以A元素为K,B元素为Cl,C元素为S,正确答案:K,Cl,S。
,所以A元素为K,B元素为Cl,C元素为S,正确答案:K,Cl,S。
(2)![]() 微粒中由两种元素组成的双原子分子为HCl, HCl为共价化合物,电子式表示形成过程为
微粒中由两种元素组成的双原子分子为HCl, HCl为共价化合物,电子式表示形成过程为![]() →
→![]() ,正确答案:
,正确答案:![]() →
→![]() 。
。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,则该物质是![]() ;
;![]() 与水反应生成HF和氧气,其反应方程式为: 2F2+2H2O=4HF+O2;正确答案: F2 ;2F2+2H2O=4HF+O2 。 (4) F分子中含有6个原子,且满足
与水反应生成HF和氧气,其反应方程式为: 2F2+2H2O=4HF+O2;正确答案: F2 ;2F2+2H2O=4HF+O2 。 (4) F分子中含有6个原子,且满足![]() 微粒可能是N2H4 或CH4O;正确答案:N2H4 或CH4O。
微粒可能是N2H4 或CH4O;正确答案:N2H4 或CH4O。

练习册系列答案
相关题目