题目内容
14.将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能含有乙烷 |
分析 标况下3.36L二氧化碳的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此进行解答.
解答 解:标况下3.36L二氧化碳的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,可能含有乙烯,一定没有乙烷,所以A正确,BCD错误,故选:A.
点评 本题考查有机物推断,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,常用方法有:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.

练习册系列答案
相关题目
16.下列物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是( )
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 振荡、分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
2.生活中下列物质的应用或现象解释错误的是( )
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 大量燃烧化石燃料是造成雾霾天气的重要因素之一 | |
| C. | 食盐可作调味剂,也可作食品防腐剂 | |
| D. | 装饰材料释放的甲醛会造成空气污染 |
9.下列相关的离子方程式书写正确的是( )
| A. | NaHS溶液水解:HS-+H2O?S2-+H3O+ | |
| B. | 向Ca(C1O)2溶液中通入SO2:SO2+2ClO-+H2O=SO32-+2HClO | |
| C. | 硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O |
19.K35ClO3与K37Cl在酸性溶液中反应生成氯气,则该氯气的相对分子质量为( )
| A. | 70.7 | B. | 70.2 | C. | 72 | D. | 73.3 |
6.某有机物A是农药生产中的一种中间体,其结构简式如图.下列叙述正确的是( )


| A. | 有机物A属于芳香烃 | |
| B. | 有机物A能和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A能和 NaOH乙醇溶液发生消去反应 |
3.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
4.下列说法中正确的是( )
| A. | 苯酚中羟基对苯环的影响是使苯环上氢原子都变的很活泼 | |
| B. | 酯在碱性条件下的水解生成相应的羧酸和醇 | |
| C. | 参与酯化反应的物质一定有两种 | |
| D. | 能发生银镜反应的物质不一定是醛 |
 .
.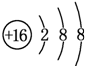 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).