题目内容
19.K35ClO3与K37Cl在酸性溶液中反应生成氯气,则该氯气的相对分子质量为( )| A. | 70.7 | B. | 70.2 | C. | 72 | D. | 73.3 |
分析 反应的方程式为K35ClO3+6H37Cl=K37Cl+Cl2↑+3H2O,生成的Cl2中,35Cl与37Cl个数比为1:5,然后根据摩尔质量与相对分子质量在数值上相等求解.
解答 解:K35ClO3晶体与H37Cl浓溶液发生反应生成氯气、氯化钾和水,方程式为K35ClO3+6H37Cl=K37Cl+Cl2↑+3H2O,生成的Cl2中,35Cl与37Cl个数比为1:5,生成的氯气相对分子质量约为$\frac{37×5+35}{3}$=73.3,
故选D.
点评 本题考查了氧化还原反应,明确反应中元素的化合价变化及原子守恒为解答的关键,题目难度不大.

练习册系列答案
相关题目
1.${\;}_{27}^{60}$Co是γ放射源,${\;}_{27}^{60}$Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对${\;}_{27}^{60}$Co原子的叙述正确的是( )
| A. | 质量数是27 | B. | 质子数是60 | C. | 中子数是27 | D. | 质子数是27 |
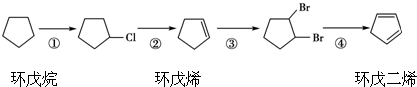
10. 下列各组物质中,能一步实现右图所示①~⑤转化关系的是( )
下列各组物质中,能一步实现右图所示①~⑤转化关系的是( )
 下列各组物质中,能一步实现右图所示①~⑤转化关系的是( )
下列各组物质中,能一步实现右图所示①~⑤转化关系的是( )| X | Y | Z | W | |
| A | Fe3O4 | Fe | FeCl2 | FeCl3 |
| B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | Si | SiO2 | Na2SiO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
14.将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能含有乙烷 |
4.常温下可以盛放浓硫酸的容器是( )
| A. | 塑料 | B. | Fe | C. | Al | D. | Mg |
11.由乙烯(C2H4)和乙醛(C2H4O)组成的混和气体,经测定其中碳的质量分数是72%,则混和气体中氧的质量分数是( )
| A. | 36.36% | B. | 22.22% | C. | 16.00% | D. | 12.00% |
8.活泼金属氢化物是火箭燃料的重要供氢剂,如氢化钠、氢化钙等.例如,氢化钙的供氢原理是CaH2+2H2O=Ca(OH)2+2H2下列有关分析中正确的是( )
| A. | 氢化钙中含共价键,水中含非极性键 | |
| B. | 水分子和氢分子中都存在氢氢非极性共价键 | |
| C. | 氢氧化钙只存在离子键 | |
| D. | 该反应断裂离子键和共价键,生成离子键和共价键 |
 ,
,
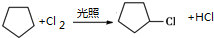 ;(方程式中物质可用键线式表示,下同)
;(方程式中物质可用键线式表示,下同) ;
;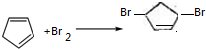 .
.
