题目内容
11.在一定温度下,10L密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),开始加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应.(1)O2的转化率33.3%.
(2)平衡时容器内气体压强与反应前的压强之比16:19.
(3)平衡时体系中SO3的体积分数37.5%.
(4)平衡常数K=7.5.
分析 在一定温度下,10L密闭容器中,开始加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):5 4.5 0
变化量(mol):3 1.5 3
平衡量(mol):2 3 3
(1)转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(2)恒温恒容下,压强之比等于物质的量之比;
(3)平衡时体系中SO3的体积分数=$\frac{三氧化硫物质的量}{混合气体总物质的量}$;
(4)平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
解答 解:在一定温度下,10L密闭容器中,开始加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):5 4.5 0
变化量(mol):3 1.5 3
平衡量(mol):2 3 3
(1)O2转化率=$\frac{1.5mol}{4.5mol}$×100%=33.3%,故答案为:33.3%;
(2)恒温恒容下,压强之比等于物质的量之比,则平衡时容器内气体压强与反应前的压强之比为8mol:9.5mol=16:19,故答案为:16:19;
(3)平衡时体系中SO3的体积分数=$\frac{3mol}{8mol}$=37.5%,故答案为:37.55;
(4)平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{0.{3}^{2}}{0.{2}^{2}×0.3}$=7.5,故答案为:7.5.
点评 本题考查化学平衡有关计算,难度不大,注意三段式解题法在化学平衡计算中应用.

 水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1(1)该反应的平衡常数的表达式为K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,升高温度K将减小(填“增大”、“减小”或“不变”).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡不移动(填“向左移”、“向右移”或“不移动”).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻缩小容器体积,请在图中继续画出t1时刻之后正、逆反应速率(ν正、ν逆)随时间的变化:
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3.PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓H2SO4;E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用1是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止黄磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.
| A. | 使用节水型马桶 | B. | 合理使用农药和化肥 | ||
| C. | 生活污水任意排放 | D. | 工业废水处理达标后排放 |
| A. | 保存液溴时用水封 | |
| B. | 用待测液润洗滴定用的锥形瓶 | |
| C. | 用稀盐酸洗涤做过银镜反应的试管 | |
| D. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
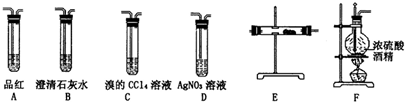 某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.
某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.