题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
【答案】D
【解析】A,根据Cl守恒,溶液中2n(Cl2)+n(HClO)+n(ClO-)+n(Cl-)=2mol,A项错误;B,n(Cu)=![]() =0.1mol,根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成NO2物质的量为0.2mol,B项错误;C,淀粉水解的方程式为
=0.1mol,根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成NO2物质的量为0.2mol,B项错误;C,淀粉水解的方程式为![]() ,1mol淀粉水解后生成nmol葡萄糖,C项错误;D,n(SO2)=
,1mol淀粉水解后生成nmol葡萄糖,C项错误;D,n(SO2)=![]() =2mol,Na2O2与SO2的反应为Na2O2+SO2=Na2SO4,用单线桥分析反应为:
=2mol,Na2O2与SO2的反应为Na2O2+SO2=Na2SO4,用单线桥分析反应为:![]() ,1molNa2O2与1molSO2反应转移2mol电子,2molNa2O2与2molSO2反应转移4mol电子,D项正确;答案选D。
,1molNa2O2与1molSO2反应转移2mol电子,2molNa2O2与2molSO2反应转移4mol电子,D项正确;答案选D。

【题目】MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
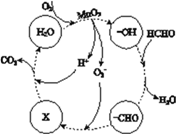
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。