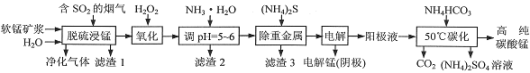
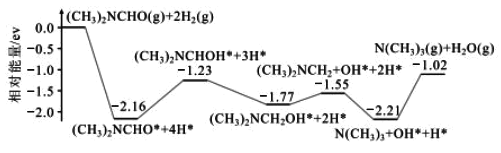
题目内容
【题目】水是生命的源泉、工业的血液、城市的命脉。河水01是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和溉溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1molL-1的NaOH溶液中,由水电离出的c(OH-)=___molL-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___。
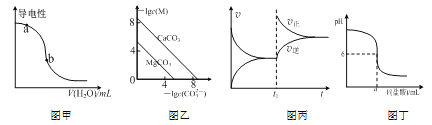
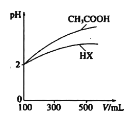
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___(填“大于”或“小于”或“等丁”)CH3COOH的电离平衡常数,理由是___。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
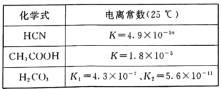
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为____。
②向NaCN溶液中通人少量的C02,发生反应的化学方程式为___。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=___molL-1(填精确值)。
【答案】10-12mol·L-1。 CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH- 小于 稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
H2CO3+OH- 小于 稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
【解析】
(1)纯水在100℃时,Kw=10-12,1mol·L-1的NaOH溶液中由水电离出的c(OH-)等于溶液中的c(H+);
(2)碳酸钠为强碱弱酸盐,溶液呈碱性,碳酸钠的水解反应分步进行,以第一步为主;
(3)根据图像可知,稀释相同体积时,HX的pH变化量比醋酸的小;
(4)强碱弱酸盐对应的酸的酸性越弱,其水解程度就越大,pH越大,弱酸的电离平衡常数越小。
(5)25℃时,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)计算。
(1)纯水在100℃时,pH=6,即c(H+)=c(OH-)=10-6mol·L-1,可知Kw=10-12,1mol·L-1的NaOH溶液中由水电离出的c(OH-)等于溶液中的c(H+),即c水电离(OH-)=c(H+)=10-12mol·L-1。
(2)碳酸钠为强碱弱酸盐,溶液呈碱性,碳酸钠的水解反应分步进行,以第一步为主,则电离方程式为CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)根据图像可知,稀释相同体积时,HX的pH变化量比醋酸的小,则HX的酸性较弱,电离平衡常数较小;
(4)强碱弱酸盐对应的酸的酸性越弱,其水解程度就越大,pH越大,弱酸的电离平衡常数越小。
①25℃时,根据表中数据可知,酸性:CH3COOH>HCN>HCO3-,则溶液的pH由大到小的顺序为Na2CO3溶液、NaCN溶液、CH3COONa溶液;
②K2小于K(HCN),K1大于K(HCN),因此向NaCN溶液中通入少量的CO2,产物应是NaHCO3,反应的方程式为NaCN+H2O+CO2=HCN+NaHCO3;
(5)25℃时,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液的pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,故c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7mol/L。

【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
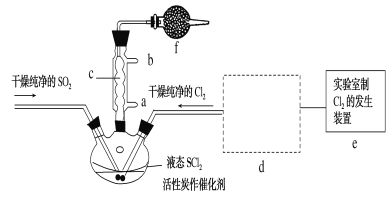
(1)下列四种制备SO2的方案中最佳选择是__。
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。