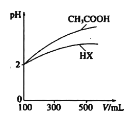
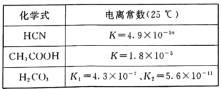
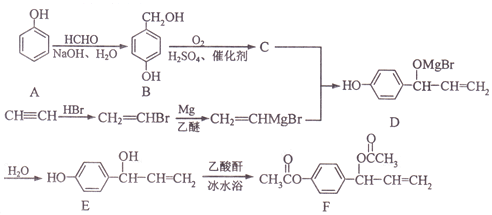
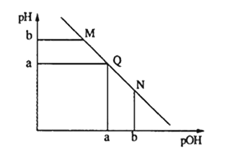
题目内容
【题目】三甲胺N(CH3)3是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N—二甲基甲酰胺(N(CH3)2NCHO,简称DMF)转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
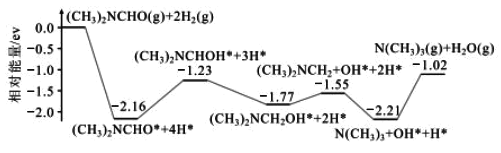
该历程中最大能垒(活化能)=__eV,该步骤的化学方程式为__。
(2)该反应变化的ΔH__0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为__。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=__(Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是__。
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为__(填“a→b”或“b→a”),负极的电极反应式为__。

【答案】1.19 N(CH3)3+OH-+H+=N(CH3)3↑+H2O↑ < (CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02NAev/mol ![]() 增大压强、增大氢气浓度 a→b 2N(CH3)3-42e-+12H2O=N2↑+6CO2↑+42H+
增大压强、增大氢气浓度 a→b 2N(CH3)3-42e-+12H2O=N2↑+6CO2↑+42H+
【解析】
(1)如图所示,反应历程中反应物和生成物相对能量差值最大的为最大能垒;
(2)如图所示,根据盖斯定律分析,反应物总能量高于生成物总能量,结合图示书写热化学反应方程式;
(3)利用“三段式”,结合相同条件下,压强之比等于物质的量之比,计算压强表示的平衡常数;
(4)根据燃料电池的特点判断正负极,结合图示及电解质溶液书写电极反应式。
(1)如图所示,反应历程中反应物和生成物相对能量差值最大的为最大能垒,即N(CH3)3+OH-+H+=N(CH3)3↑+H2O↑反应过程中活化能最大,活化能=2.21 eV -1.02 eV =1.19 eV;
(2)如图所示,根据盖斯定律,反应热只与反应始态和终态有关,与反应过程无关,反应物总能量高于生成物总能量,该反应为放热反应,ΔH<0,单一DMF分子反应释放的能量为1.02eV,1mol该分子放出的能量为1.02NAeV,热化学反应方程式:(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02NAeV/mol;
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,设DMF(g)和H2(g)的初始投入物质的量为1mol和2mol,列“三段式”:
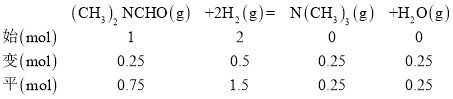
根据![]() ,则p平=
,则p平=![]() =
=![]() p0;则该反应的平衡常数Kp=
p0;则该反应的平衡常数Kp=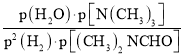 =
=![]() ;能够增大DMF平衡转化率同时加快反应速率的操作:增大压强、增大氢气浓度;
;能够增大DMF平衡转化率同时加快反应速率的操作:增大压强、增大氢气浓度;
(4)该电池为燃料电池,a电极上氧气得电子发生还原反应,b电极上三甲胺失电子发生氧化反应,则a为正极,b为负极,原电池中电子从负极流向正极即从b流向a,电流的方向与电子的移动方向相反,则外电路电流的方向为a→b;电解质溶液为酸性,结合图示,负极的电极反应式为:2N(CH3)3-42e-+12H2O=N2↑+6CO2↑+42H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案