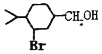
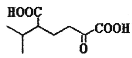
题目内容
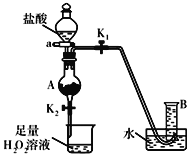
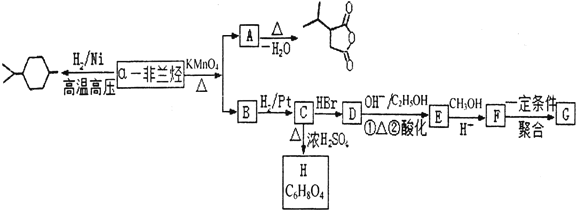
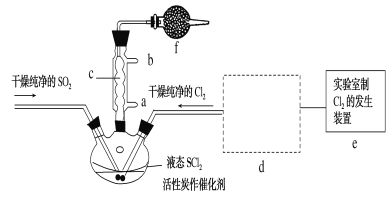
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
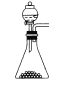
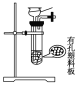
(1)下列四种制备SO2的方案中最佳选择是__。
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。
【答案】A MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 防止空气中的水蒸气进入冷凝管,使产品变质,同时吸收尾气SO2、Cl2,防止污染空气 饱和食盐水 浓硫酸 蒸馏 BaCl2或KSCN或K3[Fe(CN)6]溶液
Mn2++Cl2↑+2H2O 防止空气中的水蒸气进入冷凝管,使产品变质,同时吸收尾气SO2、Cl2,防止污染空气 饱和食盐水 浓硫酸 蒸馏 BaCl2或KSCN或K3[Fe(CN)6]溶液
【解析】
(1) 从反应原理、原料的利用率及能源消耗等角度分析;
(2)二氧化锰与浓盐酸再加热条件下反应生成MnCl2、氯气与水;
(3) SOCl2遇水会发生水解反应,Cl2、SO2有毒,会污染空气;
(4)装置d干燥氯气,且除去HCl;
(5)氯化亚砜沸点为77℃,Cl2的沸点为50℃,所以采用分馏的方法即可将之分离;
(6) 若发生氧化还原反应,则Fe3+被还原为Fe2+,而SOCl2水解得到的SO2被氧化为H2SO4。
(1)A中反应生成硫酸钾、二氧化硫和水制取二氧化硫比较合理;B中18.4mol/L的硫酸太浓,其中水分过少硫酸仍以分子形式存在,无法与铜反应制取二氧化硫;C中无论是浓硝酸还是稀硝酸都具有强氧化性可将+4价硫氧化为+6价,无法得到二氧化硫;D中加热亚硫酸氢钠确实会产生二氧化硫,但也同时产生水,所以向下倾斜试管不合理;故答案为:A;
(2)实验室利用二氧化锰和浓盐酸混合加热制氯气,发生的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)f作用为防止空气中水蒸气进入冷凝管,产品变质,同时吸收SO2、Cl2,防止污染空气,故答案为:防止空气中的水蒸气进入冷凝管,使产品变质,同时吸收尾气SO2、Cl2,防止污染空气;
(4)装置e中产生Cl2含有水、HCl,则小框内包含一个盛装饱和食盐水的洗气瓶除去HCl,一个盛装浓硫酸的干燥装置;故答案为:饱和食盐水;浓硫酸;
(5)已知氯化亚砜沸点为77℃,SCl2的沸点为50℃,则采用蒸馏的方法将其分离,故答案为:蒸馏;
(6)若发生氧化还原反应,则Fe3+被还原为Fe2+,而SOCl2水解得到的SO2被氧化为H2SO4,实验证明脱水时发生氧化还原反应方案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若产生白色沉淀,则证明脱水过程发生了氧化还原反应;方法二:往试管中加水溶解,检验是否生成Fe2+或检验Fe3+是否存在,即加入K3[Fe(CN)6]检验Fe2+或加入KSCN检验Fe3+是否存在,故答案为:BaCl2或KSCN或K3[Fe(CN)6]溶液。