题目内容
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
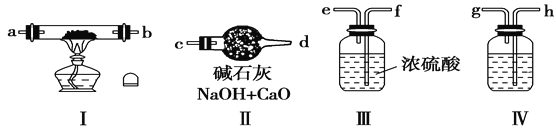
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
【答案】 Ⅲ Ⅰ Ⅱ 氢氧化钠溶液 吸收通入空气中的二氧化碳 防止空气中的水蒸气和二氧化碳进入装置Ⅰ 2Na+O2 ![]() Na2O2 D
Na2O2 D
【解析】装置Ⅳ中盛放的溶液为氢氧化钠,空气进入装置Ⅳ,目的除去空气中二氧化碳,然后进入Ⅲ装置,进行气体的干燥后,气体进入Ⅰ装置,与金属钠反应,装置Ⅱ与Ⅰ装置进行连接,保证外界空气中的水蒸气和二氧化碳气体不能进入装置Ⅰ,干扰实验;
(1)Ⅲ; Ⅰ; Ⅱ;
(2)氢氧化钠溶液;吸收通入空气中的二氧化碳;
(3)防止空气中的水蒸气和二氧化碳进入装置Ⅰ
(4)2Na+O2 ![]() Na2O2 ;
Na2O2 ;
(5)A.Na2O2能够与酸反应,生成盐和氧气、水,不属于碱性氧化物;A错误;B. Na2O2与水反应生成氢氧化钠,紫色石蕊试液遇碱变蓝,Na2O2具有强氧化性,过量的Na2O2能够使蓝色溶液褪色,B错误;C.Na2O2与水反应时,Na2O2中的-1价的O,既被氧化为O2,又被还原为-2价O, Na2O2既做氧化剂又做还原剂;C错误;D.Na2O2与CO2反应时,Na2O2中的-1价的O元素,既被氧化为O2,又被还原为-2价O, Na2O2既做氧化剂又做还原剂;D正确;正确选项:D。

【题目】高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的__________周期_________族。下面有关硅材料的说法中正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知:

请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g) △H=_____________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:________________________________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用_________________方法提纯SiHCl3。
物质 | SiHCl3 | SiCl4 | AsCl3 |
沸点/℃ | 32.0 | 57.5 | 131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
C.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HC1和另一种物质,写出配平的化学反应方程式:____________________________________。