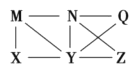
��Ŀ����
����Ŀ����A��B��C��D ���ֻ�����ֱ���K+ ��Ba2+ ��SO42 ��CO32��OH�е�������ɣ����Ǿ����������ʣ���A������ˮ�������B������ˮ�����������ᣬ���ų���ɫ�̼�����ζ������E����C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A����D������ˮ������������ʱ�ų�����E��E��ʹ����ʯ��ˮ����ǡ�
��1���ƶ�A��B��C��D�Ļ�ѧʽ��
A____________��B____________��C_____________��D____________��
��2��д�����з�Ӧ�����ӷ���ʽ��
C�����ᷴӦ___________________________________________________
B�����ᷴӦ_______________________________________________________
������E�����ʯ��ˮ��Ӧ___________________________________________
���𰸡�BaSO4 BaCO3 Ba(OH)2 K2CO3 OH����H+ �� H2O BaCO3 + 2 H+ = Ba2+ + H2O + CO2 CO2 + OH�� = HCO3��
��������
![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����ɵĻ������У�
����ɵĻ������У�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��������ˮ�Ļ����
��������ˮ�Ļ����![]() ��
��![]() ��������ˮ�Ҳ�������Ļ����
��������ˮ�Ҳ�������Ļ����![]() ��������ˮ���������ҷų���ɫ��ζ��E��
��������ˮ���������ҷų���ɫ��ζ��E��![]() ���ܹ������ᡢ����ų���ɫ��ζ����Ļ���������ǣ�
���ܹ������ᡢ����ų���ɫ��ζ����Ļ���������ǣ�![]() ��
��![]() ��ˮ��Һ�ʼ��Եģ�
��ˮ��Һ�ʼ��Եģ�![]() ��
��![]() ��
��![]() ��E��ʹ����ʯ��ˮ����ǣ�E��
��E��ʹ����ʯ��ˮ����ǣ�E��![]() ��
��
��1��A�Ȳ�����ˮ�ֲ������ᣬAΪ![]() ��B������ˮ�����������ᣬBΪ
��B������ˮ�����������ᣬBΪ![]() ��C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A��CΪ
��C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A��CΪ![]() ��EΪ��ɫ�̼�����ζ�ҿ�ʹ����ʯ��ˮ����ǵ����壬EΪ
��EΪ��ɫ�̼�����ζ�ҿ�ʹ����ʯ��ˮ����ǵ����壬EΪ![]() ��D������ˮ������������ʱ�ų�����E��DΪ
��D������ˮ������������ʱ�ų�����E��DΪ![]()
��2��CΪ![]() �������ᷴӦ�Ļ�ѧ��Ӧ����ʽΪ��
�������ᷴӦ�Ļ�ѧ��Ӧ����ʽΪ��![]() �������ӷ�Ӧ����ʽΪ��
�������ӷ�Ӧ����ʽΪ��![]() ��BΪ
��BΪ![]() �������ᷴӦ�ĵĻ�ѧ��Ӧ����ʽΪ��
�������ᷴӦ�ĵĻ�ѧ��Ӧ����ʽΪ��![]() �������ӷ�Ӧ����ʽΪ��
�������ӷ�Ӧ����ʽΪ��![]() ��EΪ
��EΪ![]() ��������
��������![]() �����ʯ��ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ��
�����ʯ��ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ��![]() �������ӷ�Ӧ����ʽΪ��
�������ӷ�Ӧ����ʽΪ��![]()