题目内容
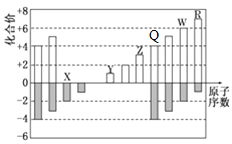
【题目】原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。
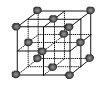
(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
【答案】(1)3d104s1、C<O<N
(2)CO2(N2O或其它合理答案)
(3)5mol(4)NH3能于水形成氢键
(5)①sp2、sp3②配位键;平面三角形
(6)①12②1:3
【解析】
试题分析:原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,则X是C,Z是O,所以Y是N;W基态原子的除第四层只有1个电子外,其余内层均为全满结构,因此W的原子序数是28+1=29,即W是Cu。
(1)铜基态原子的价电子排布式为3d104s1。同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C。
(2)原子数和价电子数分别都相等的是等电子体,因此与CNO-互为等电子体的一种分子为CO2或N2O。
(3)单键都是σ键,双键中含有1个σ键和1个π键,所以1 mol H2CO3分子中含有σ键的数目为5NA。
(4)NH3能于水形成氢键,所以氨气极易溶于水;
(5)①尿素H2NCONH2,结构式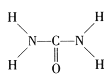 , C原子形成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,即C、N原子的杂化方式分别是sp2、sp3;
, C原子形成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,即C、N原子的杂化方式分别是sp2、sp3;
②Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,H2NCONH2与Fe(Ⅲ)之间形成配位键,。硝酸根中N原子的价层电子对数=![]() =3,不含有孤对电子,所以NO3—的空间构型为平面三角形;
=3,不含有孤对电子,所以NO3—的空间构型为平面三角形;
(6)①以顶点的二氧化碳分子研究,最近的二氧化碳位于面心上,将晶胞补全可知, 3层每层各有4个二氧化碳分子与之最近,则最近的二氧化碳分子有4×3=12;
②若顶点为Au、面心为Cu,晶胞中含有Au原子数目为8×1/8=1,晶胞中含有Cu原子数目为6×1/2=3,则铜金合金晶体中Au与Cu原子数之比为1:3。

【题目】为提纯下列物质(括号内物质是杂质),所选用的除杂试剂和分离方法都正确的是
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 淀粉(NaCl) | 水 | 渗析 |
B | 乙烷 (乙烯) | 高锰酸钾溶液 | 洗气 |
C | 乙醇(乙酸) | 新制氧化钙 | 过滤 |
D | 苯(溴) | 碘化钾溶液 | 分液 |
A. A B. B C. C D. D