题目内容
(11分)pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
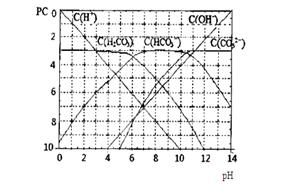
(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
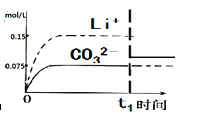
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1,若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。

(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1

(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1,若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。

(1)HCO3- CO32-+H+ HCO3-
CO32-+H+ HCO3- H2CO3 + OH- (2分)
H2CO3 + OH- (2分)
(2) 10-6 (2分)
(3)用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。 (2分)
(4) C(Li+)=0.075mol/l;C(CO32-)=0.1mol/l;Qc=C(CO32-) C2(Li+)=5.6x10-4< Ksp
无沉淀。(准确表达过程3分。只提无沉淀1分)
(5)(2分)
 CO32-+H+ HCO3-
CO32-+H+ HCO3- H2CO3 + OH- (2分)
H2CO3 + OH- (2分)(2) 10-6 (2分)
(3)用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。 (2分)
(4) C(Li+)=0.075mol/l;C(CO32-)=0.1mol/l;Qc=C(CO32-) C2(Li+)=5.6x10-4< Ksp
无沉淀。(准确表达过程3分。只提无沉淀1分)
(5)(2分)

(1)HCO3-既存在电离平衡,又存在水解平衡,所以能起到稳定人体PH的作用,方程式为HCO3- CO32-+H+、HCO3-
CO32-+H+、HCO3- H2CO3 + OH- 。
H2CO3 + OH- 。
(2)根据图像可知,当碳酸的浓度是10-3mol/L时,氢离子和HCO3-的浓度分别是10-3mol/L、10-6mol/L,所以Ka1

(3)如果0.1mol·L-1碳酸钠的水解程度时10%,则溶液的pH=12,所以可以通过pH试纸测量起pH即可,即用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。
(4)加入100 mL0.125 mol·L-1 Na2CO3溶液后,溶液中c(Li+)=0.075 mol·L-1,c(CO32-)=0.1mol·L-1,此时c(Li+)2×c(CO32-)=5.6x10-4< Ksp,所以无沉淀生成。
(5)根据(4)可知 t1时刻后c(Li+)=0.075 mol·L-1,c(CO32-)=0.1mol·L-1,所以图像为(见答案)。
 CO32-+H+、HCO3-
CO32-+H+、HCO3- H2CO3 + OH- 。
H2CO3 + OH- 。(2)根据图像可知,当碳酸的浓度是10-3mol/L时,氢离子和HCO3-的浓度分别是10-3mol/L、10-6mol/L,所以Ka1


(3)如果0.1mol·L-1碳酸钠的水解程度时10%,则溶液的pH=12,所以可以通过pH试纸测量起pH即可,即用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。
(4)加入100 mL0.125 mol·L-1 Na2CO3溶液后,溶液中c(Li+)=0.075 mol·L-1,c(CO32-)=0.1mol·L-1,此时c(Li+)2×c(CO32-)=5.6x10-4< Ksp,所以无沉淀生成。
(5)根据(4)可知 t1时刻后c(Li+)=0.075 mol·L-1,c(CO32-)=0.1mol·L-1,所以图像为(见答案)。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目

 、
、 、
、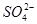
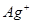 、
、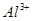 、
、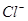
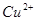 、
、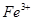 、
、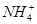 、
、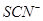
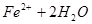

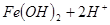 ,则往浅绿色的
,则往浅绿色的 溶液中逐滴加入稀盐酸,溶液颜色的变化情况是
溶液中逐滴加入稀盐酸,溶液颜色的变化情况是