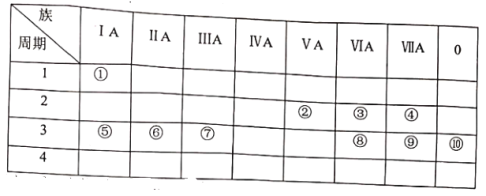
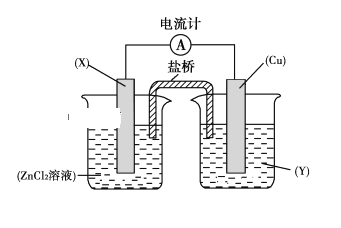
题目内容
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题:
(1)电源的N端为_________极;
(2)电极b上发生的电极反应为______________________________________;
(3)电极f上生成的气体在标准状况下的体积______________;
(4)电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是____________________;
(5)电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液__________;乙溶液____________。
【答案】正2I--2e-= I25.6 L溶液变蓝增大减小
【解析】
考查电解原理,(1)乙装置电解是CuSO4溶液,c电极质量增加,发生Cu2++2e-=Cu,因此c电极为阴极,d电极为阳极,即M为负极,N为正极;(2)甲装置是电极KI溶液,b电极为阳极,因此电极反应式为2I--2e-=I2;(3)丙装置电解K2SO4溶液,f电极为阳极,电极反应式为4OH-4e-=O2↑+2H2O,因此有2Cu~4e-~O2↑,产生氧气的物质的量为32/(64×2)mol=0.25mol,体积为0.25×22.4L=5.6L;(4)根据问题(2),甲装置产生I2,碘单质能使淀粉变蓝;(5)甲溶液中电解反应式为I-+2H2O![]() I2+H2↑+2OH-,因此甲溶液的pH增大,乙溶液电解反应式为2Cu2++2H2O
I2+H2↑+2OH-,因此甲溶液的pH增大,乙溶液电解反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,c(H+)增大,pH减小。
2Cu+O2↑+4H+,c(H+)增大,pH减小。

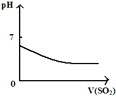
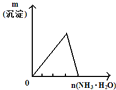
【题目】下列反应中,相关示意图像错误的是
A | B | C | D |
将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D