题目内容
【题目】已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O![]() +O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. O2和S2O![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
【答案】D
【解析】
由方程式可知3molFe2+被氧化生成Fe3O4失去2mol电子,而1mol氧气作氧化剂需要得到4mol电子,所以2molS2O![]() 必须失去2mol电子,即S2O
必须失去2mol电子,即S2O![]() 中S的化合价降低0.5的单位,S的化合价由+2价升高到+2.5价。由以上分析可知A不正确,每生成1mol Fe3O4,转移电子数为4mol,B不正确,参加反应的氧化剂与还原剂的物质的最之比为1﹕4,所以答案选D。
中S的化合价降低0.5的单位,S的化合价由+2价升高到+2.5价。由以上分析可知A不正确,每生成1mol Fe3O4,转移电子数为4mol,B不正确,参加反应的氧化剂与还原剂的物质的最之比为1﹕4,所以答案选D。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】下图为我国目前的能源消费结构图:
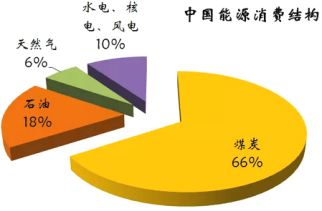
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤碳为主,但直接燃烧煤炭的弊端是_____________________________________________。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
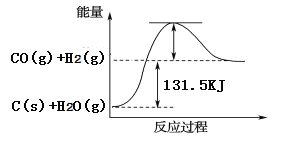
根据以上数据,写出该反应的热化学方程式_____________________________;
(3)直接燃烧水煤气的能量利用率远远低于燃料电池,请写出碱性水煤气燃料电池的负极反应式________________________,______________________。
(4)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用H2、CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.00 | 2.5 |
③3H2(g)+CO2(g) | K3 | ||
在体积一定的密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正_______ v逆(填“> ”、“= ”或“< ")。
(6)在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t变化曲线I如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。

当曲线I变为曲线II时,改变的条件可能是________。当曲线I变为曲线III时,改变的条件可能是________。