题目内容
【题目】下表是元素周期表的一部分。
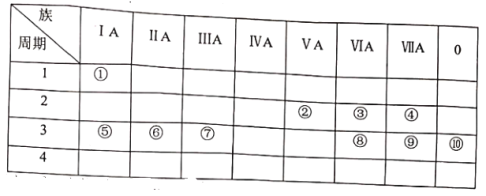
试用合适的化学用语回答下列问题:
(1)请画出元素④简单阴离子的结构示意图:____________。
(2) ③⑤⑧的原子半径由小到大的顺序为__________(填元素符号)。
(3)⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____ > _____(填化学式)。
(4) ③⑤两种元素的原子按1:1组成的常见化合物的电子式 为_______。
(5)写出⑦的单质与⑤的最高价氧化物对应水化物溶液反应的化学方程式_____________。
【答案】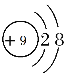 O<S<Na HClO4 H2SO4
O<S<Na HClO4 H2SO4 ![]() 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
根据元素在周期表中的位置,①~⑩元素分别是H、N、O、F、Na、Mg、Al、S、Cl、Ar。
(1)元素④是F,简单阴离子F-,核外有10个电子,结构示意图为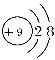 。
。
(2)同周期元素从左到右半径减小,同主族元素从上到下半径最大, O、Na、S的原子半径由小到大的顺序为O<S<Na。
(3)同周期元素从左到右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,所以HClO4> H2SO4。
(4) O、Na两种元素的原子按1:1组成的常见化合物是Na2O2,Na2O2为离子化合物,电子式 为![]() 。
。
(5)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子化学方程式2Al+2OH-+2H2O=2AlO2-+3H2↑。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施


