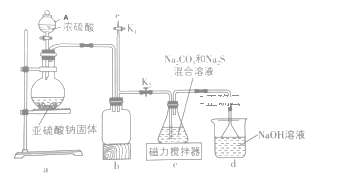
题目内容
【题目】镁、铝、铁是三种重要金属,它们的单质和化合物应用十分广泛。回答下列问题:
(1)镁、铝第一电离能大小的关系是I1(Mg)___I1(Al),金属镁、铝熔点大小关系是Mg___Al。(填“大于”、“等于”或“小于”)
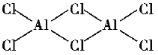
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Cl原子杂化轨道类型为___杂化,分子中所有原子___(能、不能)在同一平面上。
(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁]。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为___。尿素分子中σ键与π键的数目之比为___。NO3-的空间构型为___,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为___杂化。
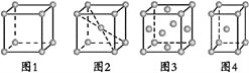
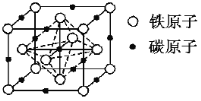
(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有___个,该物质的化学式为___。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___pm(阿伏加德罗常数的值为NA表示,写出简化后的计算式即可)。
【答案】大于 小于 sp3 不能 1s22s22p63s23p63d5 7:1 平面三角形 sp 12 FeC 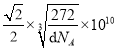
【解析】
(1)同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;金属熔沸点与金属键强弱有关;
(2)根据结构简式判断其成键特点,分析杂化方式;
(3)Fe为26号元素,原子形成阳离子时,先失去高能层中电子,同一能层先失去高能级中电子;尿素的结构式为![]() ;根据价层电子对数判断杂化类型,根据价层电子对互斥判断空间构型;
;根据价层电子对数判断杂化类型,根据价层电子对互斥判断空间构型;
(4)以顶点Fe原子研究,与之距离最近的Fe原子处于面心,利用“均摊法”确定化学式;根据晶胞可以判断出两个碳原子的最近距离为面对角线的一半。
(1)镁失去能量较低的3s上成对电子,铝失去能量较高的3p上成单电子,故I1(Mg)大于I1 (A1);铝比镁价电子多,离子半径小,金属键强、品体熔点高,
故答案为:大于;小于;
(2)中问的Cl原子有两个σ键、孤电子对数为2,价层电子对数为4,故为sp3杂化,Al原子有4个σ键、孤电子对为0,价层电子对数为4,故为sp3杂化,与A1结合的4个Cl原子处于四面体顶点,分子中所有原子不能在同一平面上,
故答案为:sp3;不能;
(3)Fe为26号元素,原子形成阳离子时,先失去高能层中电子,同一能层先失去高能级中电子,所以基态Fe3+的核外电子排布式为1s22s22p63s23p63d5;根据尿素的结构简式可知,分子中σ键的数目为7,π键的数目1;NO3-的中心原子价层电子对数为3,没有孤电子对,故空间构型为平面三角形;NO2+的中心原子价层电子对数为2,故为sp杂化,
故答案为:1s22s22p63s23p63d5;7:1;平面三角形;sp;
(4)以顶点Fe原子研究,与之距离最近的Fe原子处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故与铁原子距离最近的铁原子数目为3×8/2=12;该晶胞中8顶点和6面心有Fe原子,晶胞含有Fe原子的数目为8×1/8+6×1/2=4,12棱心和体心有碳原子,晶胞含有碳原子数目为12×1/4+1=4,Fe原子和碳原子数目最简整数比为1:1,所以化学式为FeC;晶胞边长为a pm,根据密度计算公式可知![]() ,解得
,解得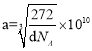 ,最近两个碳原子的距离为面对角线的一半即
,最近两个碳原子的距离为面对角线的一半即![]() ,即
,即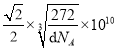
故答案为:12;FeC;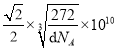 ;
;

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案