题目内容
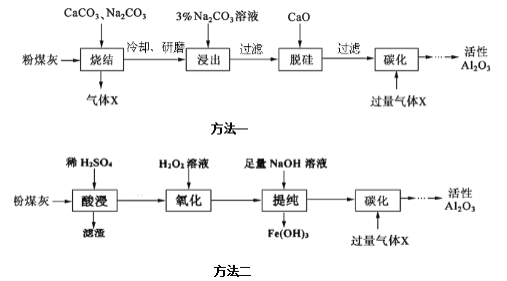
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量会不断减少
D.装置中石墨电极材料需要定期更换
【答案】C
【解析】
A.由TiO2制得1mol金属Ti,Ti元素化合价降低4价,所以转移4mol电子,故A正确;
B.石墨电极为阳极,根据图示可知石墨被氧化和氧离子生成二氧化碳,电极方程式为C+2O2--4e-=CO2↑,故B正确;
C.钙离子在阴极上被还原成钙单质,之后钙单质和TiO2反应又生成氧化钙,所以氧化钙的总量不变,故C错误;
D.根据阳极电极反应可知C不断被消耗,所以需要定期更换,故D正确;
故答案为C。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。