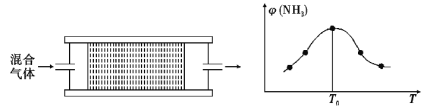
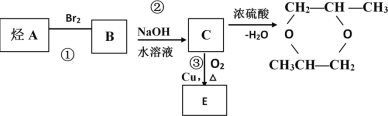
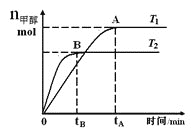
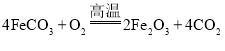题目内容
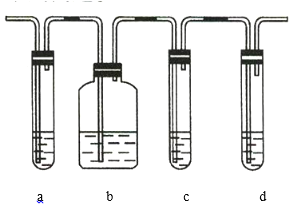
【题目】用下列实验装置进行相应实验能达到实验目的的是( )
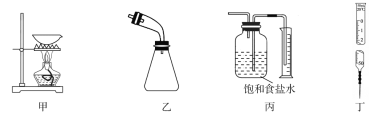
A.用甲装置从KI和I2的固体混合物中回收I2
B.用乙装置接收石油分馏实验中所得的馏分
C.用丙装置测量用MnO2和浓盐酸共热制得的Cl2体积
D.用丁装置准确量取一定体积的KMnO4标准溶液
【答案】C
【解析】
A.碘易升华,回收碘需要在上方利用玻璃片(或盛有冷水的烧瓶等)回收,图中装置不能回收碘,故A错误;
B.乙装置未与大气连通,由于气压原因,冷凝得到的液体无法进入锥形瓶,故B错误;
C.氯气难溶于饱和食盐水,集气瓶中氯气短进长出,可以将饱和食盐水压入量筒,从而确定氯气的体积,故C正确;
D.图示为碱式滴定管,高锰酸钾溶液有强氧化性,不能用碱式滴定管量取,故D错误;
故答案为C。

练习册系列答案
相关题目