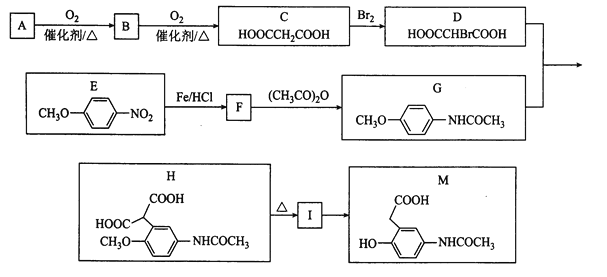
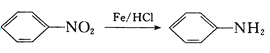
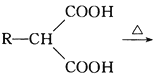
题目内容
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=___,ΔH___0(填“<”“>”或“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL-1s-1,则6s时c(A)=___molL-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为___,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为___。
(3)一定温度下,能判断该反应达化学平衡状态的是___。
①单位时间内生成nmolA,同时消耗nmolC
②A的转化率不变
③容器内压强不再变化
④混合气体的密度不再变化
⑤混合气体的平均相对分子质量不再变化
(4)1200℃时,C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为___。
A(g)+B(g)的平衡常数的值为___。
【答案】![]() < 0.022 0.09 80% 80% ①② 2.5
< 0.022 0.09 80% 80% ①② 2.5
【解析】
(1)根据平衡常数定义,可写出该反应的平衡常数表达式;根据平衡常数与温度关系可判断该反应的热效应;
(2)利用化学反应速率的定义,根据题给方程式和数据可计算6s时A的浓度、C的物质的量以及平衡时A的转化率;可根据是否改变了反应混合物各组分的浓度来判断充入氩气对转化率的影响;
(3)根据化学平衡状态的特征和平衡移动时各量的变化情况来判断可逆反应是否达化学平衡状态;
(4)互为逆反应的两个可逆反应,平衡常数的表达式互为倒数。
(1)根据平衡常数定义,该反应的平衡常数表达式为![]() ;根据题给图表,该反应的平衡常数随温度的升高而减小,说明该反应是放热反应,所以,ΔH<0。
;根据题给图表,该反应的平衡常数随温度的升高而减小,说明该反应是放热反应,所以,ΔH<0。
答案为:![]() ;<;
;<;
(2)A的初始浓度为:0.20mol÷5L=0.04mol/L,反应初始6s内A浓度减小量为:c(A)=0.003molL-1s-1×6s=0.018 molL-1,故6s时c(A)=0.04mol/L-0.018 molL-1=0.022molL-1;生成的C的物质的量等于消耗的A的物质的量,所以C的物质的量n(C)= 0.018molL-1×5L=0.09mol;
830℃时,K =1.0,设反应达到平衡时反应的A的物质的量为x,则有:
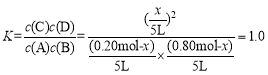
x =0.16mol,
A的转化率为:0.16mol÷0.2mol×100%=80%;
在恒容密闭容器中充入氩气,没有改变反应混合物各组分的浓度,故不影响平衡,A的转化率不变,仍为80%。
答案为:0.022;0.09;80%;80%;
(3)①单位时间内生成nmolA,同时消耗nmolC,则各物质的物质的量不变,反应达化学平衡状态,①正确;
②A的转化率不变,则A的物质的量不变,反应达化学平衡状态,②正确;
③该反应气体物质的量不变,故恒温时容器内压强不随平衡移动而改变,故不能判断反应是否达化学平衡状态,③不正确;
④ρ=m/V,混合气体的质量和体积在反应中均不变,所以密度始终不变,故不能判断反应是否达化学平衡状态,④不正确;
⑤混合气体的平均相对分子质量![]() =m/n,混合气体的质量和物质的量在反应中均不变,所以平均相对分子质量始终不变,故不能判断反应是否达化学平衡状态,⑤不正确;
=m/n,混合气体的质量和物质的量在反应中均不变,所以平均相对分子质量始终不变,故不能判断反应是否达化学平衡状态,⑤不正确;
答案为:①②;
(4)反应C(g)+D(g)![]() A(g)+B(g)与反应A(g)+B(g)
A(g)+B(g)与反应A(g)+B(g)![]() C(g)+D(g) 互为逆反应,同温时平衡常数互为倒数,所以1200℃时,C(g)+D(g)
C(g)+D(g) 互为逆反应,同温时平衡常数互为倒数,所以1200℃时,C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为1÷0.4=2.5。
A(g)+B(g)的平衡常数的值为1÷0.4=2.5。
答案为:2.5

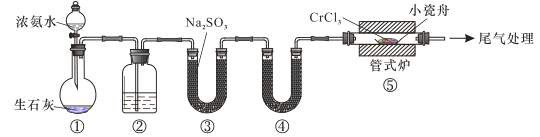
【题目】如图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷舟内的烃样品经加热分解或气化后用纯![]() 流驱赶经过灼热的
流驱赶经过灼热的![]() ,这里烃类化合物反应变成
,这里烃类化合物反应变成![]() 和
和![]() ,经吸收管吸收。
,经吸收管吸收。
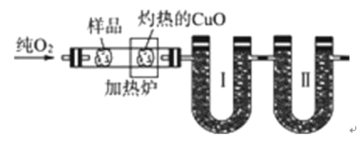
已知下表数据:
瓷舟 | 吸收管Ⅰ | 吸收管Ⅱ | |||
瓷舟 | 样品+瓷舟 | 吸收前 | 吸收后 | 吸收前 | 吸收后 |
A | B | C | D | E | F |
(1)烃样品在反应过程中所用的氧化剂是________________________;
(2)吸收管Ⅰ应装的吸收剂是____________,吸收管Ⅱ应装的吸收剂是____________;
(3)样品中碳的质量分数的数学表达式是________________________;
(4)取该烃![]() 在氧气中充分燃烧后,生成
在氧气中充分燃烧后,生成![]() 和
和![]() 。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。
。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。