题目内容
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
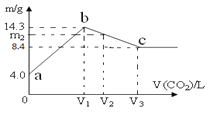
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
【答案】高温 CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) 大于 0.848p0 Cl2和O2分离能耗较高、HCl转化率较低 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化 ClO3-+H2O-2e-=ClO4-+2H+
【解析】
(1)Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1,△S>0,则要△G=△H-T△S<0,须高温条件下才能自发;
Cl2(g) ΔH1=+83kJ·mol-1,△S>0,则要△G=△H-T△S<0,须高温条件下才能自发;
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,(Ⅲ-Ⅱ×2-Ⅰ×2)/2得:还需要利用反应CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)的ΔH。
故答案为:高温;CuO(s)+2HCl(g)=CuCl2(s)+H2O(g);
(2)根据图象可知,进料浓度比相同时,温度越高HCl平衡转化率越低,说明该反应为放热反应,升高温度平衡向着逆向移动,则温度越高平衡常数越小,所以反应平衡常数K(400℃)大于K(500℃);进料浓度比c(HCl):c(O2)的比值越大,HCl的平衡转化率越低,根据图象可知,相同温度时HCl转化率最高的为进料浓度比c(HCl):c(O2)=4:1,该曲线中400℃HCl的平衡转化率为76%。则

p=![]() p0=0.848p0;
p0=0.848p0;
进料浓度比c(HCl):c(O2)过低时,O2浓度较大,HCl的转化率较高,但Cl2和O2分离能耗较高,生成成本提高;进料浓度比c(HCl):c(O2)过高时,O2浓度较低,导致HCl的转化率减小;
故答案为:大于;p=![]() p0=0.848p0;Cl2和O2分离能耗较高、HCl转化率较低;
p0=0.848p0;Cl2和O2分离能耗较高、HCl转化率较低;
(3)生成NaClO3的反应分两步进行:Ⅰ.2ClO-=ClO2-+Cl-,Ⅱ.ClO2-+ClO-=ClO3-+Cl-,常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,用碰撞理论解释其原因:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
(4)电解NaClO3水溶液可制备NaClO4,阳极发生氧化反应生成ClO4-,阳极反应式:ClO3-+H2O-2e-=ClO4-+2H+。
故答案为:ClO3-+H2O-2e-=ClO4-+2H+。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
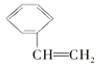
小学数学口算题卡脱口而出系列答案【题目】已知:-CHO+(C6H5)3P=CH-R -CH=CH-R + (C6H5)3P=O,R代表原子或原子团,W是一种有机合成中间体,结构简式为:HOOC-CH=CH-CH=CH-COOH,其合成方法如下:
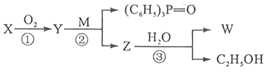
其中,![]() 分别代表一种有机物,合成过程中其他产物和反应条件已略去。
分别代表一种有机物,合成过程中其他产物和反应条件已略去。
X与W在一定条件下反应可以生成酯N,N的相对分子质量为168。
请回答下列问题:
(1)W能发生反应的类型有__________。(填写字母编号)
A.取代反应 | B.水解反应 | C.氧化反应 | D.加成反应 |
(2)写出X与 W在一定条件下反应生成N的化学方程式:___________________。
(3)写出含有3个碳原子且不含甲基的X的同系物的结构简式_________________
(4)写出第②步反应的化学方程式:____________________________________。