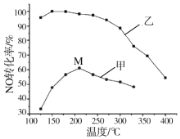
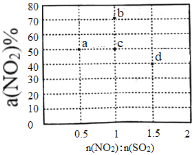
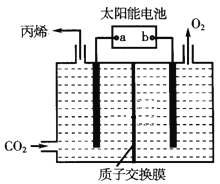
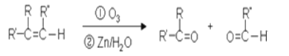
题目内容
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后没有未配对电子;C原子的2p轨道上没有空轨道上且电子的自旋方向相同;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)下列元素的名称是:B:________;E:________;
(2)D原子在元素周期表的___________区。
(3)C原子的电子排布图____________________。
(4)B原子的核外价电子排布式________________。
【答案】氯 氩 s 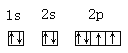 3s23p5
3s23p5
【解析】
A原子中只有一个电子层且只含1个电子,则A是H元素;B原子3p轨道上得到1个电子后不能再容纳外来电子,则B是Cl元素;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反,则C是O元素;D原子第三层上有8个电子,第四层上只有1个电子,则D是K元素;E原子的外围电子排布为3s23p6,则E是Ar元素。
(1)B为Cl元素,E是Ar元素,故答案为:氯;氩;
(2)D是K元素,价电子排布式为4s1,位于元素周期表的s区,故答案为:s;
(3)C是O元素,O原子的电子排布式为1s22s22p6,电子排布图为 ,故答案为:
,故答案为: ;
;
(4)B是Cl元素,最外层有7个电子,Cl原子的价电子排布式为3s23p5,故答案为:3s23p5。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量