题目内容
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
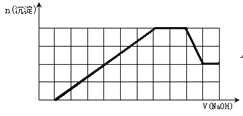
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C. 原溶液中一定含有SO42-和Na+
D. 反应最后形成的溶液中含有的溶质只有Na2SO4
【答案】B
【解析】第一阶段加入NaOH溶液没有产生沉淀,原溶液中一定含H+,发生的反应为H++OH-=H2O;第二阶段加入NaOH溶液产生沉淀逐渐增多达最大,说明Mg2+、Fe3+、Al3+三者中至少存在一种;第三阶段加入NaOH溶液沉淀既不增多也不减少,原溶液中一定含NH4+,发生的反应为NH4++OH-=NH3·H2O;第四阶段加入NaOH溶液沉淀部分溶解,则原溶液中一定含Al3+,Mg2+、Fe3+中至少存在一种,根据离子反应Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,生成Al(OH)3沉淀和Al(OH)3完全溶解消耗的NaOH溶液的体积之比为3:1;根据纵坐标Al(OH)3沉淀物质的量与不溶于NaOH的沉淀物质的量相等,横坐标Al3+和金属阳离子完全沉淀与Al(OH)3完全溶解消耗的NaOH溶液的体积之比为6:1,则原溶液中一定含有Fe3+,一定不含Mg2+,且Al3+与Fe3+物质的量相等。A,原溶液中含有的阳离子有H+、Al3+、Fe3+、NH4+,不含Mg2+,A项错误;B,原溶液中Fe3+与Al3+物质的量之比为1:1,B项正确;C,由于CO32-与H+、Al3+、Fe3+不能大量共存,原溶液中一定不含CO32-,根据电荷守恒,原溶液中一定含SO42-,无法判断原溶液中是否含Na+,C项错误;D,反应最后形成的溶液中含Na2SO4、NaAlO2和NH3·H2O,D项错误;答案选B。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO45H2O)及副产物ZnO.制备流程图如下: 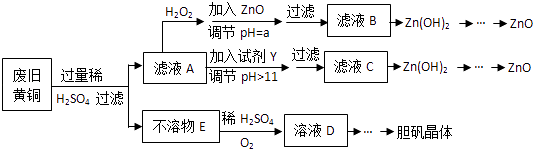
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 , a的范围是 .
(2)由不溶物E生成溶液D的化学方程式为 .
(3)滤液A中加入H2O2反应的离子方程式为 .
(4)由溶液D制胆矾晶体包含的主要操作步骤是 .
(5)下列试剂可作为Y试剂的是 . A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .