题目内容
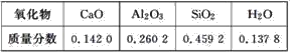
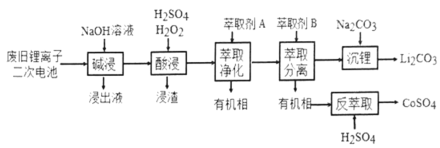
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
回答下列问题:
(1)“碱浸”目的是___________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
(3)“萃取净化”除去的杂质离子有![]() 外,还有__________。
外,还有__________。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,pH一般选择5左右,理由是______________。

(5)“沉锂”中![]() 溶解度随温度变化曲线如下图所示:
溶解度随温度变化曲线如下图所示:
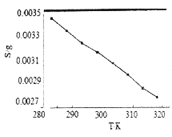
①根据平衡移动原理分析![]() 在水中溶解度随温度变化的原因____________________。
在水中溶解度随温度变化的原因____________________。
②为获得高纯![]() ,提纯操作依次为趁热过滤、________、烘干。
,提纯操作依次为趁热过滤、________、烘干。
【答案】除去铝 2LiCoO2+H2O2 +6H+=2Li++2Co2++O2↑+4H2O 石墨、硫酸钙 Fe3+ 分离效率最高 Li2CO3溶解过程为放热反应 洗涤
【解析】
根据流程和题意碱浸除去的是溶于碱溶液的铝;酸浸的目的是把+3价的钴还原为+2价,同时使Ca2+转化为硫酸钙和不溶的碳一起过滤除去;萃取净化的目的是除去镍和铁,萃取分离是分离锂和钴。
(1)“碱浸”的目的是用氢氧化钠溶液将其中的Al溶解,将Al除去;
(2)LiCoO2中Co为+3价,最后生成的CoSO4中Co为+2价,所以酸浸这一步中,加入H2O2的目的是为了将+3价Co还原为+2价Co,H2O2做还原剂,生成氧气,所以反应的离子反应方程式为:2 LiCoO2 + H2O2 + 6H+=2Li++2Co2+ + O2↑ + 4 H2O;浸渣中主要是不与酸反应的石墨以及生成的硫酸钙沉淀。
(3)整个提取的过程中需要除去的杂质是Ca、Fe、Al、Ni;在前面的步骤中已经除去了Al和Ca,所以萃取净化应该要除去Ni2+和Fe3+。
(4)由图示在pH为5左右的时候,Co和Li的萃取率差异最大,此时分离的效果最好。
(5)①图中显示随着温度升高,碳酸锂的溶解度逐渐减小,根据平衡移动的原理,温度升高,平衡向吸热方向进行,所以碳酸锂溶于水的过程是放热的。
②对物质进行提纯,在过滤和烘干之间,必须洗涤,以保证得到的物质纯度较高,所以答案为:洗涤。