题目内容
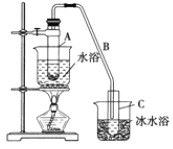
【题目】某化学小组采用类似制乙酸乙酯的装置![]() 如下图
如下图![]() 以环己醇为原料制备环己烯。
以环己醇为原料制备环己烯。
已知: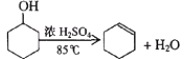
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在____层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________。
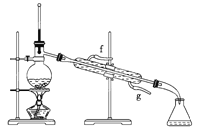
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
【答案】(1)①防爆沸;冷凝
②防止环己烯挥发
(2)①上;c;②g;除去水分;③83C;c
(3)bc
【解析】
(1)粗品的制备既要防止反应物暴沸,又要防止生成物挥发,故答案为:①防止液体暴沸、冷凝②防止环己烯挥发;(2)精品的制备关键在于除杂,此问涉及到分液和蒸馏。环己烯密度比水小,在上层,洗涤时选用KMnO4溶液会氧化环己烯,又因粗品中混有少量酸性物质,洗涤时不能再用稀H2SO4,需用Na2CO3溶液将多余的酸除掉。其中的水分可用生石灰除去。 由于环己醇的沸点较低,制备粗品时随产品一起蒸出,导致环己烯精品产量低于理论值。故答案为:①上、c②g、吸收水分,便于蒸馏出更纯净的产品③83 ℃、c;(3)区分精品与粗品不能选用酸性KMnO4溶液,因为二者皆可被酸性KMnO4溶液氧化;由于粗品中含有环己醇等,可与钠反应产生气体,故可用Na加以区分;测定沸点也能很好的区分二者。故答案为:bc。

【题目】某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验。
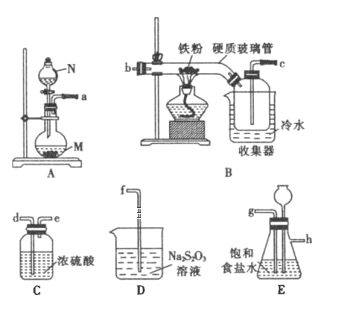
已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
(1)仪器N的名称是________。N中盛有浓盐酸,烧瓶M中的固体试剂是________(填化学式)。实验室配制FeCl3溶液时需将FeCl3固体溶于较浓的盐酸中,其原因是 ______(用离子方程式表示)
(2)装置的连接顺序为________→________→________→________→________→________→________→d→e→f。(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是________。
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中发生反应的离子方程式为______________________。
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是________(用离子方程式表示)。
②已知红色褪去的同时有气体生成,经检验气体为O2。该小组对红色褪去的原因进行探究。
实验 | 操作 | 现象 | |
实验Ⅰ(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
实验Ⅱ(取与褪色后的溶液浓度相同的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
由实验Ⅰ和Ⅱ可得出的结论为________。