题目内容
【题目】硝酸是常见的无机强酸,是重要的化工原料。实验室模拟硝酸的制备可用以下装置,其中a为一个可持续鼓入空气的橡皮球,b、c为止水夹。

(1)实验开始前,应检验装置的气密性,请写出检验A~E装置(不必考虑a)的气密性方法________________。
(2)装置A中发生反应的化学方程式为___________。装置C中浓硫酸的作用是__________。
(3)实验进行一段时间,待制备一定量硝酸后,停止加热A和B中装置,但仍要通过a鼓入一定量的空气,该操作的目的是____________________。
(4)若F装置中所选用试剂为酸性KMnO4溶液,请写出F装置处理NO尾气的离子方程式:_____________________。
(5)欲使A中产生的氨气尽可能转化为硝酸,理论上氨气与鼓入空气的最佳比例为_______。
(6)实验完毕后,取E中的溶液,加入几滴酚酞溶液,用0.10 mol/L的NaOH标准液滴定,发现加入过量标准液后仍无现象,试解释没有观察到滴定终点的原因_________________。
【答案】将E中右侧导管浸没在水中,打开b和c,微热A中试管,最右侧导管口有气泡产生,停止加热冷却至室温,最右侧导管有一段回流水柱(无“E中右侧导管浸没在水中”不得分,无“打开b和c”可给分) 2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O; 除水蒸气和氨气 使氧气与氮氧化物及水反应成硝酸,提高氮氧化物的转化率 5NO+4H++3MnO4-=3Mn2++5NO3-+2H2O 1:10 硝酸将酚酞氧化
2NH3↑+CaCl2+2H2O; 除水蒸气和氨气 使氧气与氮氧化物及水反应成硝酸,提高氮氧化物的转化率 5NO+4H++3MnO4-=3Mn2++5NO3-+2H2O 1:10 硝酸将酚酞氧化
【解析】
(1)检验A~E装置(不必考虑a)的气密性方法是将E中右侧导管浸没在水中,打开b和c,微热A中试管,最右侧导管口有气泡产生,停止加热冷却至室温,最右侧导管有一段回流水柱;综上所述,本题答案是:将E中右侧导管浸没在水中,打开b和c,微热A中试管,最右侧导管口有气泡产生,停止加热冷却至室温,最右侧导管有一段回流水柱(无“E中右侧导管浸没在水中”不得分,无“打开b和c”可给分)。
(2) 装置A中为氯化铵固体与氢氧化钙固体加热反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;氨气和氧气反应生成一氧化氮和水,会有氨气剩余,因此装置C中浓硫酸的作用是除水蒸气和氨气;综上所述,本题答案是:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;氨气和氧气反应生成一氧化氮和水,会有氨气剩余,因此装置C中浓硫酸的作用是除水蒸气和氨气;综上所述,本题答案是:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O; 除水蒸气和氨气。
2NH3↑+CaCl2+2H2O; 除水蒸气和氨气。
(3) 氮的氧化物能够与氧气、水共同作用生成硝酸,停止加热A和B中装置,但仍要通过a鼓入一定量的空气,可以提高氮氧化物的转化率,提高硝酸的产率;综上所述,本题答案是:使氧气与氮氧化物及水反应成硝酸,提高氮氧化物的转化率。
(4)酸性KMnO4溶液具有强氧化性,能够把NO氧化为硝酸根离子,变为无害物质,反应的离子方程式5NO+4H++3MnO4-=3Mn2++5NO3-+2H2O;综上所述,本题答案是:5NO+4H++3MnO4-=3Mn2++5NO3-+2H2O。
(5) 氨气中-3价氮被氧化到+5价,氧气中0价氧被还原到-2价,设氨气有xmol,氧气有ymol,根据电子得失守恒可知:8x=4y,x:y=1:2,,空气中氧气大约占1/5体积,所以理论上氨气与鼓入空气的最佳比例为1:10;综上所述,本题答案是:1:10。
(6)硝酸具有氧化性,能够将酚酞氧化为无色;综上所述,本题答案是:硝酸将酚酞氧化。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】用下列实验装置进行相应的实验,不能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A. A B. B C. C D. D
【题目】某化学小组采用类似制乙酸乙酯的装置![]() 如下图
如下图![]() 以环己醇为原料制备环己烯。
以环己醇为原料制备环己烯。
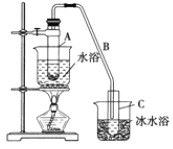
已知: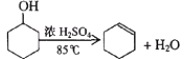
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在____层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________。
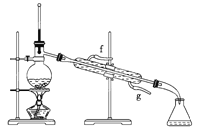
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点