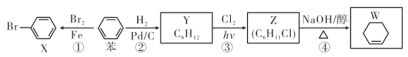
题目内容
【题目】现有常见金属A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间的转化关系如图所示,请根据以上信息回答下列问题:
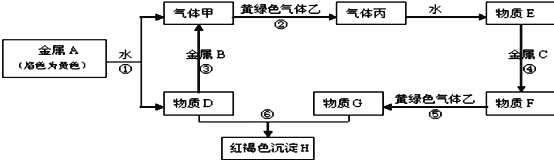
(1)写出下列物质的化学式:B _______ F______
(2)写出下列反应离子方程式:
反应⑤________________
反应⑥_______________
(3)实验室制取气体乙时,先将气体生成物通过 _______以除去_______
(4)在反应MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O中,浓盐酸体现了_____ 性和__________性,参加反应的氧化剂与还原剂的物质的量之比为_____。
【答案】Al FeCl2 2Fe2++Cl2 === 2Fe3++ 2Cl- Fe3++ 3OH- == Fe(OH)3↓ 饱和食盐水 HCl气体 还原性 酸性 1:2
【解析】
金属A焰色反应为黄色,故A为金属Na,由反应①可以知道,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al。黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl![]() 物质F
物质F![]() 物质G,可以知道金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题。
物质G,可以知道金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题。
(1)由以上分析可以知道,B为Al,F为FeCl2,
因此,本题正确答案是:Al ;FeCl2;
(2)反应⑤为氯化亚铁与氯气反应生成氯化铁,反应离子方程式为:2Fe2++Cl2 === 2Fe3++ 2Cl-;
反应(6)是氯化铁与氢氧化钠反应生成氢氧化铁沉淀与氯化钠,反应离子方程式为:Fe3++ 3OH- == Fe(OH)3↓;
因此,本题正确答案是:2Fe2++Cl2 === 2Fe3++ 2Cl- ;Fe3++ 3OH- == Fe(OH)3↓;
(3)实验室用二氧化锰和浓盐酸加热制Cl2时,氯气中混有HCl和水蒸气,要先将气体生成物通过饱和食盐水以除去HCl气体,
因此,本题正确答案是:饱和食盐水;HCl气体;
(4)在反应MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O中,Mn元素的化合价降低,MnO2为氧化剂,部分Cl元素的化合价升高,则HCl为还原剂,浓盐酸体现了还原性和酸性,由电子守恒可知,氧化剂与还原剂的物质的量比为1:2,
MnCl2 + Cl2↑+ 2H2O中,Mn元素的化合价降低,MnO2为氧化剂,部分Cl元素的化合价升高,则HCl为还原剂,浓盐酸体现了还原性和酸性,由电子守恒可知,氧化剂与还原剂的物质的量比为1:2,
因此,本题正确答案是:还原性;酸性;1:2。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】用下列实验装置进行相应的实验,不能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A. A B. B C. C D. D
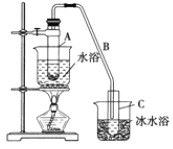
【题目】某化学小组采用类似制乙酸乙酯的装置![]() 如下图
如下图![]() 以环己醇为原料制备环己烯。
以环己醇为原料制备环己烯。
已知: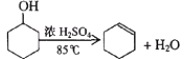
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在____层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________。
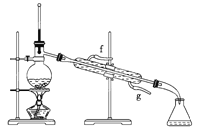
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点