题目内容
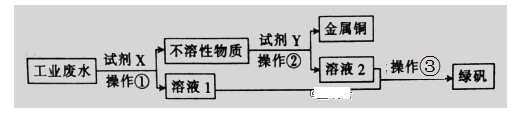
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
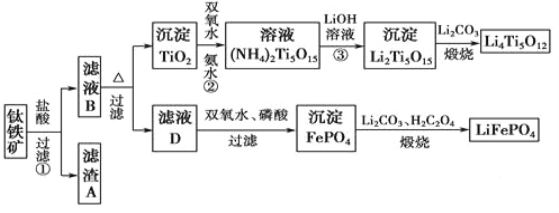
(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
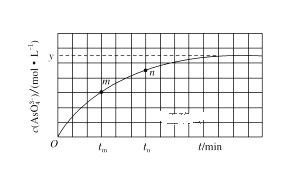
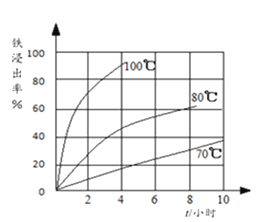
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。

(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
【答案】第四周期IVB增大反应物接触面积,加快反应速率100℃ 3小时温度过高,双氧水分解与氨气逸出导致Ti元素浸出率下降2Fe2++ H2O2+ 2H3PO4 == 2FePO4 + 4H++ 2H2O2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+ 3CO2↑+ H2O
2LiFePO4+ 3CO2↑+ H2O
【解析】
(1)Ti的原子序数为22,处于第四周期第ⅣB族。钛铁矿在预处理时进行粉碎,增大了与盐酸的接触面积,可以加快反应速率。
(2)由图中三条曲线可得,当铁的浸出率为80%时,应为100℃、约浸取3小时。
(3)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解(双氧水分解与氨气逸出),所以反应温度过高时,Ti元素浸出率下降。
(4)由流程可得,滤液D含有Fe2+,与H2O2、H3PO4反应,生成FePO4,离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4+ 4H++2H2O。
(5)由流程图可知FePO4与H2C2O4、Li2CO3高温煅烧发生反应生成LiFePO4,铁的化合价降低,FePO4应为氧化剂,所以H2C2O4应为还原剂,故化学方程式为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+3CO2↑+H2O。
2LiFePO4+3CO2↑+H2O。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2CH3OH
Ⅱ.CO2+3H2CH3OH+H2O
Ⅲ.CO2+H2CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
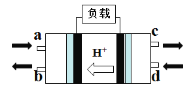
①c处产生的气体是________。
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
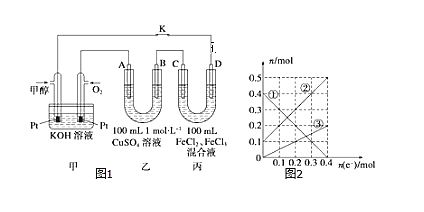
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。