题目内容
【题目】按要求填空:
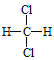
(1)S2-的结构示意图为__________;7 g 35Cl2所含的中子数为________。
(2)下列物质中,能导电的有____________;属于电解质的是_________。
①石墨②CO2 ③液态HCl ④Na2CO3固体 ⑤熔融Al2O3 ⑥葡萄糖 ⑦KOH溶液
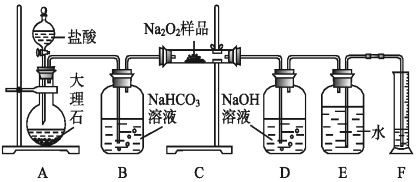
(3)工业上电解饱和食盐水制氯气的化学方程式为_____________,用双线桥表示其电子转移。
【答案】![]() 3.6NA ①⑤⑦ ③④⑤
3.6NA ①⑤⑦ ③④⑤ 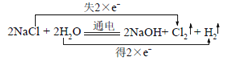
【解析】
(1)硫是16号元素,得2个电子形成硫离子,S2-的结构示意图为![]() ;7 g 35Cl2所含的中子数为
;7 g 35Cl2所含的中子数为![]() ×(35-17)×NA=3.6NA;
×(35-17)×NA=3.6NA;
(2)含有自由移动离子或电子的物质能导电,①石墨中含有自由移动电子⑤熔融Al2O3 ⑦KOH溶液中含有自由移动离子,能导电的有①⑤⑦;在水溶液里或熔融状态下能导电的化合物是电解质,所以属于电解质的是③液态HCl ④Na2CO3固体 ⑤熔融Al2O3 ;而①石墨属于单质 ⑦KOH溶液属于混合物,不属于电解质;②CO2 ⑥葡萄糖属于非电解质;
(3)工业上电解饱和食盐水生成氯气、氢气和氢氧化钠,用双线桥表示其电子转移: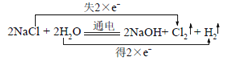 。
。

【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:

已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。