题目内容
【题目】将0.1mol/L的AlCl3溶液加热、蒸干、灼烧最后得到的固体是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
【答案】D
【解析】解:AlCl3溶液在加热时水解生成Al(OH)3 , 生成的HCl易挥发,最终生成Al(OH)3 , 在加强热时,Al(OH)3不稳定,分解生成Al2O3 . 故选D.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4) :
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。某同学进行实验,实验装置如图。其中A、B的成分见表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
② | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
③ | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该反应的离子方程式为_____________________________,实验结束后读数前需要移动量气管,使两个量气管的液面相平。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/mL | 10 | 5 | 0 | X |
0.5mol/LH2C2O4/mL | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
时间/S | 40 | 20 | 10 | ______ |
(2) X=______,4号实验中始终没有观察到溶液褪色,你认为可能的原因是________________。
(3)2号反应中,H2C2O4的反应速率为_____________。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/S | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
结合实验目的与表中数据,你得出的结论是_______________________。
(5)从影响化学反应速率的因素看,你的猜想还可能是______________的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_________。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJmol﹣1 , 计算H﹣F键的键能为 .
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJ.mol﹣1) | 414 | 489 | ? | 155 |
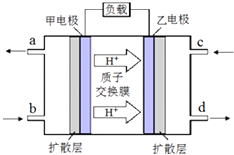
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,二者均可利用CO和H2反应合成. ①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32﹣﹣12e﹣═8CO2+3H2O.写出该燃料电池的正极反应式 .
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式 .
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气. ①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为 .
②反应池中发生的离子反应方程式为 .