题目内容
【题目】工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________。
【答案】3C(s) + Al2O3(s)+N2(g)=2AlN(s)+3CO(g) △H = +1026KJ/mol阴极和阳极产生的氧气反应K=c (CH4)c2( H2O)/c( CO2)c4(H2) CO2+6H2O+8e﹣═ CH4+8OH﹣
【解析】
(1)盖斯定律计算,(①+②×3+③×2)×1/2得到碳热还原Al2O3合成AlN的总热化学方程式。
(2)由电解原理可知,阴极上铝离子得到电子,阳极上是氧离子失电子发生氧化反应;
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体.因此,需要不断补充石墨电极;
(3)①依方程式结合平衡常数的概念写出平衡常数的表达式。
②CO2可以在碱性水溶液中电解生成甲烷,二氧化碳得电子生成甲烷。
(1)已知:①2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
②2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
③2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
盖斯定律计算,(①+②×3+③×2)×1/2得到碳热还原Al2O3合成AlN的总热化学方程式,3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+1026KJ·mol-1·L-1。
(2)①由电解原理可知,阴极上铝离子得到电子生成铝,故铝在阴极上生成;阳极上是氧离子失电子发生氧化反应,电解时阳极的电极反应式为:2O2--4e-=O2↑;
②电解过程中作阳极的石墨易消耗,原因是石墨电极被阳极上产生的氧气氧化。
(3)①依方程式结合平衡常数的概念写出平衡常数的表达式:K=c (CH4)c2( H2O)/c( CO2)c4(H2) ;
②CO2可以在碱性水溶液中电解生成甲烷,二氧化碳得电子生成甲烷,电极反应式是CO2+6H2O+8e﹣═ CH4+8OH﹣。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。
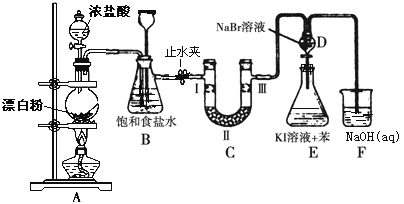
(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。