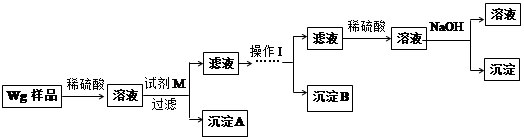题目内容
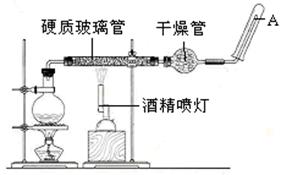
红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式: 。
(2)干燥管C内盛放的药品是 和 (填化学式)。干燥管的 (填“m”或“n”)端与g导管相连接。
(3)在D处画出用试管收集氢气的装置图(所需其他仪器自行选择)。
(4)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象 。
(1)3Fe+4H2O(g) Fe3O4+4H2 (2)CaCl2 CaO n
Fe3O4+4H2 (2)CaCl2 CaO n
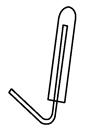
(3)
(4)用拇指堵住试管口,试管口向上,靠近酒精灯火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2。
解析试题分析:⑴铁在高温下与水蒸气反应的化学方程式:3Fe+4H2O(g) Fe3O4+4H2 ;⑵装置使用干燥管是干燥氢气中的水蒸气,干燥管中可装不与H2反应的干燥剂,如CaCl2、CaO等,干燥管中气体应从大管进,小管出,所以n端与g导管相连接
Fe3O4+4H2 ;⑵装置使用干燥管是干燥氢气中的水蒸气,干燥管中可装不与H2反应的干燥剂,如CaCl2、CaO等,干燥管中气体应从大管进,小管出,所以n端与g导管相连接
⑶H2密度小于空气,应用向下排空法收集,用试管收集氢气的装置图为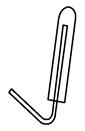 ⑷检验收集到的气体是氢气,操作为:用拇指堵住试管口,试管口向上,靠近酒精灯火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2,答案:用拇指堵住试管口,试管口向上,靠近酒精灯火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2。
⑷检验收集到的气体是氢气,操作为:用拇指堵住试管口,试管口向上,靠近酒精灯火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2,答案:用拇指堵住试管口,试管口向上,靠近酒精灯火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2。
考点:铁及其化合物的性质实验

为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题: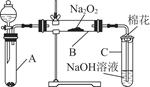
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 | , |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中 | |
| | 若 , |
| 则证明生成物中有Na2SO3;若 | |
| | |
| 则说明生成物中没有Na2SO3。 | |
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为 。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为 。
我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 。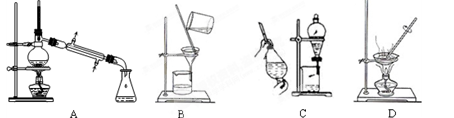
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl—和NH4+,实验室鉴定Cl—所选用的试剂是、,鉴定另一种杂质离子的方法是 (填序号)。
| A.加水,将湿润的红色石蕊试纸放在试管口 |
| B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C.加氢氧化钠溶液,加热,滴入酚酞试剂 |
| D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂 |
下列试剂中,不能贮存在玻璃瓶中的是
| A.浓硫酸 | B.氢氟酸 | C.浓氢氧化钠溶液 | D.硝酸银溶液 |