题目内容
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:______________________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)某无色溶液可能存在如下离子:Ag+、Ba2+和由上推出的元素组成的离子E+、F3+、FD2―、G2―、BD32―、GD32―、GD42―,现取该溶液进行有关实验,结果如下图所示。
①生成淡黄色沉淀的离子方程式为 。
②由溶液甲生成沉淀乙的离子方程式 。
③综合上述信息,可以肯定存在的离子有 。
(1)非极性共价键、离子键(各1分)
(2)N2(g)+3H2(g)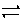 2NH3(g);△H=-92.2kJ/mol(2分)
2NH3(g);△H=-92.2kJ/mol(2分)
三角锥形(1分) sp3(1分)
(3) Na3N + 4H2O=3NaOH + NH3·H2O (2分)
(4)1s22s22p63s23p63d104s1 结构简式略 有深蓝色晶体析出(各1分)
(5)①2S2―+SO32―+6H+=3S↓+3H2O (2分)
②Al3++3HCO3―=Al(OH)3↓+3CO2↑(2分)
③Na+、S2―、SO32―、AlO2―(4分)
解析试题分析:根据题干信息:A是氢、B是碳、C是氮、D是氧、E是钠、F是铝、G是硫、H是铜。
Na2O2中含有非极性共价键和离子键。
信息表示合成氨的热化学方程式。
Na3N能与水反应生成两种的碱NaOH和NH3
Cu离子可以与水形成四水合铜配合物。
①淡黄色沉淀是硫单质 ②产生沉淀和气体说明发生了Al3+和3HCO3―的双水解 ③略
考点:本题考查了元素化合物的知识,有物质的推导,热化学方程式的书写,双水解方程式的书写等,综合性比较强。

对于反应:3S+6NaOH=2Na2S+Na2SO3+3H2O, 以下说法正确的是( )
| A.该反应既属于四种基本类型的反应,又属于氧化还原反应 |
| B.氧元素被还原,硫元素被氧化 |
| C.每有3 mol S参加反应转移6 mol电子 |
| D.S既是氧化剂又是还原剂 |