题目内容
对于反应:3S+6NaOH=2Na2S+Na2SO3+3H2O, 以下说法正确的是( )
| A.该反应既属于四种基本类型的反应,又属于氧化还原反应 |
| B.氧元素被还原,硫元素被氧化 |
| C.每有3 mol S参加反应转移6 mol电子 |
| D.S既是氧化剂又是还原剂 |
D
解析试题分析:A.该反应不属于四种基本类型的任一反应,但是属于氧化还原反应,错误;B.在该反应中硫元素既被还原,也被氧化,错误;C.每有3 mol S参加反应转移4 mol电子,错误;D.因为S的化合价既升高又降低,所以S既是氧化剂又是还原剂,正确。
考点:考查关于S的单质参加的反应的分类及性质的知识。

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
铁溶于一定浓度的硝酸时,发生反应的离子方程式为:
aFe+bNO3-+cH+═dFe2++fFe3++gNO↑+hNO2↑+kH20,下列有关推断中,不正确的是( )
| A.2d+3f=3g+h |
| B.c+b=2d+3f |
| C.HNO3的氧化性强于Fe3+ |
| D.反应中每消耗5.6gFe,转移0.2mol~0.3mole- |
下列变化中,需加入适当氧化剂才能完成的是
| A.CuO → Cu | B.KCl→AgCl | C.Fe→FeCl3 | D.HNO3 → NO |
已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+, Sn2++2Fe3+===2Fe2++Sn4+;由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则n一定大于0.15 mol |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1 |
对于反应3Cl2+6NaOH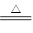 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是
| A.X是H2SO4 |
| B.反应中Mn原子与Bi原子个数比为5:2 |
| C.该反应中NaBiO3作氧化剂 |
| D.该反应中Na2SO4既不是氧化产物,又不是还原产物 |
