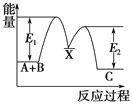
题目内容
【题目】用KMnO4氧化盐酸溶液.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56L,
计算
(1)参加反应的HCl的物质的量?
(2)反应中被氧化的HCl的物质的量?
(3)并用双线桥标出电子转移的方向和数目.
【答案】
(1)解:反应生成Cl2在标准状况下体积为56L,则氯气的物质的量为n= ![]() =
= ![]() =2.5mol,则参加反应的HCl的物质的量为2.5mol×
=2.5mol,则参加反应的HCl的物质的量为2.5mol× ![]() =8mol;
=8mol;
答:参加反应的HCl的物质的量为8mol
(2)解:反应中16molHCl只有8mol被氧化,即被氧化的HCl占总的HCl物质的量 ![]() ,所以反应中被氧化的HCl的物质的量为4mol;
,所以反应中被氧化的HCl的物质的量为4mol;
答:反应中被氧化的HCl的物质的量为4mol
(3)解:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e﹣,双线桥标出电子的转移方向和数目为 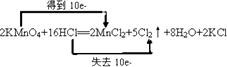 ,
,
答:并用双线桥标出电子转移的方向和数目
【解析】反应生成Cl2在标准状况下体积为56L,根据n= ![]() 计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析.
计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析.

 名校课堂系列答案
名校课堂系列答案【题目】在100℃时,体积不变的密闭容器中发生如下反应:A(g) ![]() 2B(g) ΔH>0,每隔一定时间对该容器内的物质进行分析,得到如下表格,试填空:
2B(g) ΔH>0,每隔一定时间对该容器内的物质进行分析,得到如下表格,试填空:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(A)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 | c5 |
c(B) (mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)达到平衡时A的转化率为________。在此条件下,平衡常数K为______。
(2)在0~60s时间段内,A的平均反应速率为_________________。
(3)要使平衡向正反应方向移动,可采取的措施______(填序号)。
A、体积不变时增大的A起始浓度 B、升高温度
C、使用催化剂 D、缩小容器体积
【题目】现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表).
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
A.①﹣(3)﹣分液
B.②﹣(2)﹣过滤
C.③﹣(2)﹣萃取
D.④﹣(1)﹣蒸馏