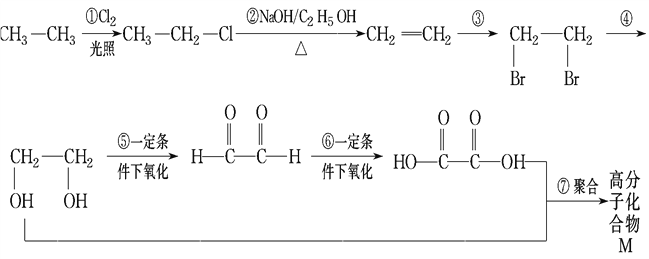
题目内容
【题目】在100℃时,体积不变的密闭容器中发生如下反应:A(g) ![]() 2B(g) ΔH>0,每隔一定时间对该容器内的物质进行分析,得到如下表格,试填空:
2B(g) ΔH>0,每隔一定时间对该容器内的物质进行分析,得到如下表格,试填空:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(A)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 | c5 |
c(B) (mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)达到平衡时A的转化率为________。在此条件下,平衡常数K为______。
(2)在0~60s时间段内,A的平均反应速率为_________________。
(3)要使平衡向正反应方向移动,可采取的措施______(填序号)。
A、体积不变时增大的A起始浓度 B、升高温度
C、使用催化剂 D、缩小容器体积
【答案】 60% 0.36 0.001 molL-1s-1 B
【解析】(1)反应的化学方程式为:A(g) ![]() 2B(g),
2B(g),
由表可知,60s时反应达平衡,平衡时c(B)=0.120mol/L,A的起始度为0.1mol/L,则:
A(g) ![]() 2B(g)
2B(g)
起始(mol/L):0.100 0
变化(mol/L):0.060 0.120
平衡(mol/L):0.040 0.120
所以平衡时A的转化率=![]() ×100%=60%,平衡常数K=
×100%=60%,平衡常数K=![]() =
=![]() =0.36,故答案为:60%;0.36;
=0.36,故答案为:60%;0.36;
(2)60s时处于平衡状态,根据①计算可知c3=0.040;由表中数据可知,60s时,v(A)= ![]() =0.001molL-1s-1,故答案为:0.001 molL-1s-1;
=0.001molL-1s-1,故答案为:0.001 molL-1s-1;
(3) A、体积不变时增大的A起始浓度,相当于增大氧气,平衡逆向移动,故A错误;B、升高温度,平衡向吸热的方向移动,平衡向正反应方向移动,故B正确;C、使用催化剂,平衡不移动,故C错误;D、缩小容器体积,压强增大,平衡逆向移动,故D错误;故选B。