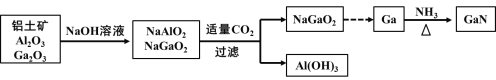
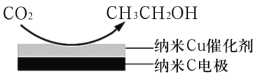
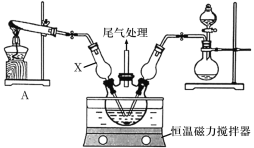
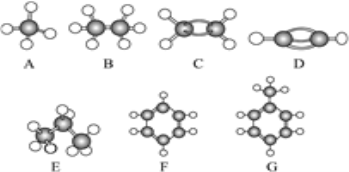
题目内容
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
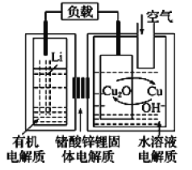
A.该电池的负极为Li
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
D.若有1 mol Li+透过固体电解质时,标准状况下参与反应的O2体积为5.6 L
【答案】C
【解析】
根据放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-可知,该反应中Li元素化合价由0价变为+1价、Cu元素化合价由+1价变为0价,所以负极上电极反应式为Li-e-=Li+、正极反应式为Cu2O+H2O+2e-=2Cu+2OH-,放电时电解质中阳离子向正极移动,以此解答该题。
A.在反应中Li元素化合价升高失去电子,所以Li为电池的负极,A正确;
B.根据放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,B正确;
C.根据电池反应式知,正极反应式为Cu2O+H2O+2e-=2Cu+2OH-,C错误;
D.若有1 mol Li+透过固体电解质时,反应转移1 mol电子,由于1 mol O2反应会得到4 mol电子,则转移1 mol电子时,需要O2的物质的量是0.25 mol,其在标准状况下体积为22.4 L/mol×0.25 mol=5.6 L,D正确;
故合理选项是C。

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目