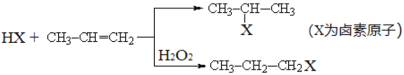
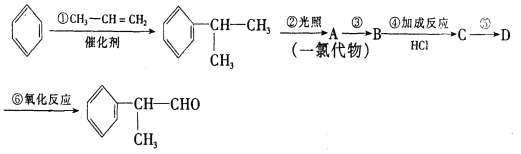
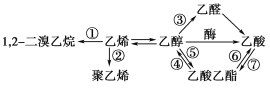
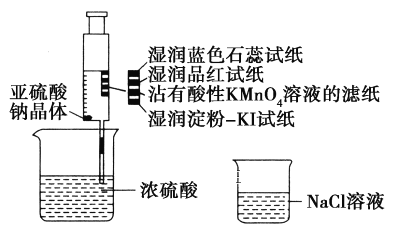
题目内容
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
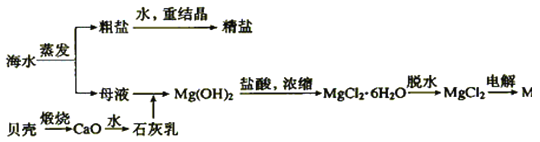
(1)写出下列反应的化学方程式。
①石灰乳与母液反应___;
②Mg(OH)2中加入盐酸的离子方程式:__;
③MgCl2![]() Mg:___。
Mg:___。
(2)在海水提取镁的过程中,没有涉及的化学反应类型__
A.分解反应 B.化合反应 C.复分解反应 D.置换反应 E.氧化还原反应
【答案】Ca(OH)2+MgCl2=Mg(OH)2+CaCl2 Mg(OH)2+2H+=Mg2++2H2O MgCl2![]() Cl2↑+Mg D
Cl2↑+Mg D
【解析】
(1)①石灰乳与母液中的氯化镁反应生成氢氧化镁和氯化钙;
②Mg(OH)2中加入盐酸,生成氯化镁和水;
③电解氯化镁生成单质镁和氯气;
(2)碳酸钙煅烧生成氧化钙和二氧化碳为分解反应;氧化钙与水反应生成氢氧化钙为化合反应;石灰乳与氯化镁、氢氧化镁与盐酸反应均为复分解反应;电解氯化镁生成氯气和镁为分解反应、氧化还原反应;未涉及置换反应。
(1)①石灰乳为氢氧化钙的悬浊液,与母液中的氯化镁反应生成氢氧化镁和氯化钙,方程式为Ca(OH)2+MgCl2=Mg(OH)2+CaCl2;
②Mg(OH)2中加入盐酸,生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;
③电解氯化镁生成单质镁和氯气,方程式为MgCl2![]() Cl2↑+Mg;
Cl2↑+Mg;
(2)碳酸钙煅烧生成氧化钙和二氧化碳为分解反应;氧化钙与水反应生成氢氧化钙为化合反应;石灰乳与氯化镁、氢氧化镁与盐酸反应均为复分解反应;电解氯化镁生成氯气和镁为分解反应、氧化还原反应;未涉及置换反应,答案为D。

 优学名师名题系列答案
优学名师名题系列答案【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管5~10min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
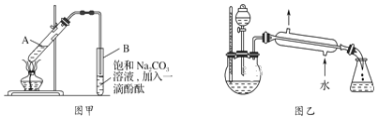
已知乙醇可以与氯化钙反应,生成微溶于水的CaCl26C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 |
乙醇 | ﹣117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | ﹣83.6 | 77.5 | 0.90 |
浓硫酸(98%) | 338.0 | 1.84 |
(1) 请用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O在反应前后位置变化的化学方程式:_______。
(2)上述实验中饱和Na2CO3溶液的作用是_____________。
(3)写出步骤③中观察到的实验现象______。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤,通过洗涤可除去的杂质是_____(填名称);干燥乙酸乙酯可选用的干燥剂为下列四个选项中的_____(填字母)。
a.P2O5 b.无水硫酸钠 c.碱石灰 d.NaOH固体
(5)某化学课外小组设计了图乙所示的装置制取乙酸乙酯(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有___(填字母)。
a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多,反应速率加快
(6)实验中加入乙酸的质量为2.1 g,最终制得1.848 g乙酸乙酯,则乙酸的转化率为_____
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
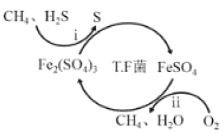
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
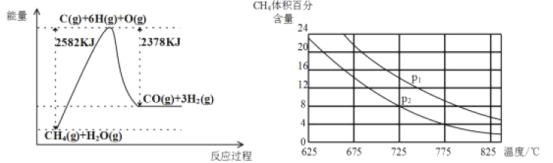
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
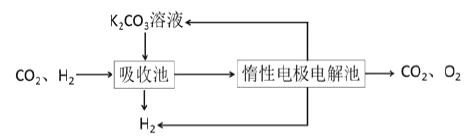
(4)吸收池中发生反应的离子方程式是______。