��Ŀ����
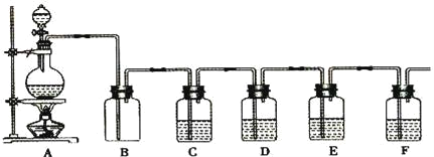
����Ŀ����������ۺ����������ڽ�Լ��Դ������������ʵ�������÷Ͼɵ�ص�ͭñ��Cu��Zn�ܺ���ԼΪ99%���Ʊ�ZnCl24H2O��CuCl22H2O�IJ���ʵ�鲽����ͼ��

��1��������Һ��������ȡZnCl24H2O��ʵ�鲽������Ϊ_____��_____�����ˡ���ˮϴ�ӡ����¸���
��2�����ܽ���������У�������Ӧ�����ӷ���ʽΪ_____
��3���Ȼ�ͭ��Һ�и���ͭ���ֵķֲ�������c��Cl�����Ĺ�ϵ��ͼ��

�ٵ�c��Cl������9molL��1ʱ����Һ����Ҫ��3�ֺ�ͭ����Ũ�ȴ�С��ϵΪ_____
����c��Cl������1molL��1���Ȼ�ͭ��Һ�У�����AgNO3��Һ�����ɰ�ɫ���������ӷ���ʽΪ_____����дһ������
��4��Ϊ�ⶨ��Ʒ����CuCl22H2O���Ĵ��ȣ���ȡ0.90g��Ʒ������ϡ���Ტ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У����������KI��ַ�Ӧ������������μ���0.02000 molL��1 Na2S2O3��Һ���պ���ȫ��Ӧ������Na2S2O3��Һ2500mL����֪��2Cu2++4I����2CuI����ɫ����+I2��2S2O32��+I2�T2I��+S4O62��
����Ʒ�����Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬����Ҫ_____��_____
��������ʵ�����ݼ�����Ʒ��CuCl22H2O������������д��������̣�______________
���𰸡�����Ũ�� ��ȴ�ᾧ Cu+H2O2+2H+��Cu2++2H2O c��CuCl2����c��CuCl+����c��CuCl3���� Ag++Cl����AgCl�� ������ 250mL����ƿ 95%
��������
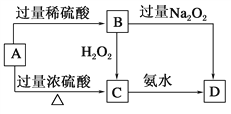
�������̣��Ͼɵ�ص�ͭñ��Cu��Zn�ܺ���ԼΪ99%����ϡ�����ܽ�Zn�����ˣ���ҺIΪ�Ȼ�п������ΪCu������˫��ˮ�������ܽ�õ��Ȼ�ͭ������Ũ������ȴ�ᾧ�õ�CuCl22H2O��
��1����ҺIΪ�Ȼ�п��Һ����������Ũ������ȴ�ᾧ�����ˡ���ˮϴ�ӡ����¸���õ�ZnCl24H2O���ʴ�Ϊ������Ũ������ȴ�ᾧ��
��2�����ܽ����������Ϊ����������ϡ�����������ܽ�ͭ���õ��Ȼ�ͭ��ˮ����ӦΪ��Cu+H2O2+2H+��Cu2++2H2O���ʴ�Ϊ��Cu+H2O2+2H+��Cu2++2H2O��
��3������c��Cl������9molL��1������һ��ƽ������������ߣ��ɼ���Һ����Ҫ��ͭ����Ũ�ȴ�С��ϵΪ��c��CuCl2����c��CuCl+����c��CuCl3������c��Cu2+����c��CuCl42�������ʴ�Ϊ��c��CuCl2����c��CuCl+����c��CuCl3������
�ڴ�ͼ�Ͽɼ�����c��Cl������1molL��1���Ȼ�ͭ��Һ�У�����AgNO3��Һ���������������������Ȼ�����ɫ��������ӦΪ��Ag++Cl����AgCl�����ʴ�Ϊ��Ag++Cl����AgCl����
��4��������250mL��Һ��Ҫ�IJ����������ձ�������ιܡ���������250ml����ƿ���ʴ�Ϊ����������250mL����ƿ��
�ڸ��������У�2Cu2+��I2��2Na2S2O3����n��Cu2+����n��Na2S2O3����0.02000mol/L��0.025L��
����Ʒ��m��CuCl22H2O����0.02000mol/L��0.025L��![]() ��171g/mol��0.855g����Ʒ��CuCl22H2O����������Ϊ��
��171g/mol��0.855g����Ʒ��CuCl22H2O����������Ϊ��![]() ��95%���ʴ�Ϊ��95%��
��95%���ʴ�Ϊ��95%��

����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ�
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50�� B. ��Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��