题目内容
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氮元素形成物质的价类二维图的及氮的循环的部分信息。
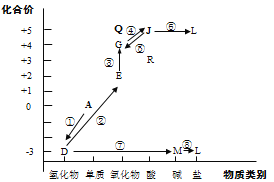
(1)①是一种人工固氮的重要途径,该反应的化学方程式是__________。
(2)②的化学方程式是__________。
(3)⑤的化学方程式是(任写一种)__________。
(4)R可与 NaOH溶液反应:HNO2+NaOH=NaNO2+H2O,该反应体现了R(HNO2)的_____性。
(5)Q的化学式是_______,Q属于酸性氧化物,写出Q与水反应的化学方程式________。
(6)L在水体中过多蓄积会导致水体富营养化。将水体调节为酸性后加入适量NaClO,可将L中阳离子转化为无污染气体以去除。写出L与NaClO反应的离子方程式_________。
【答案】N2+3H2 ![]() 2NH3 4NH3+5O2
2NH3 4NH3+5O2 ![]() 4NO+6H2O Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O或者 C+4HNO3(浓)
4NO+6H2O Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O或者 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O或者4HNO3(浓)
CO2↑+4NO2↑+2H2O或者4HNO3(浓) ![]() 4NO2↑++O2↑+2H2O(任写一种) 酸 N2O5 N2O5 +H2O=2HNO3 2NH4++3ClO-= N2↑+3Cl-+3H2O+2H+
4NO2↑++O2↑+2H2O(任写一种) 酸 N2O5 N2O5 +H2O=2HNO3 2NH4++3ClO-= N2↑+3Cl-+3H2O+2H+
【解析】
已知图中物质都是含氮元素的物质,过程①中A为单质,D为氢化物,A生成D是人工固氮反应,则为氮气和氢气在高温、高压、催化剂的条件下生成氨气的反应,则A为氮气,D为氨气;过程②中B为氮的氧化物且氮元素为+2价,则发生的反应为氨气催化氧化反应生成一氧化氮和水,则E为一氧化氮;G也是氮氧化物且氮元素的化合价为+4价,由E转变为G的反应为一氧化氮和氧气反应生成二氧化氮,则G为二氧化氮;J为含氮元素的酸且氮元素为+5价,由二氧化氮转变为酸的反应为二氧化氮、氧气和水反应生成硝酸,则J为硝酸;过程⑤为硝酸转化为二氧化氮,反应较多,如:浓硝酸与铜反应、硝酸受热分解或硝酸与碳单质反应都可产生二氧化氮;氨气转变为M,M为碱,即M为一水合氨;一水合氨也可转化为L,则L为铵盐,同时,过程⑥为硝酸转变为L,则L为硝酸铵;另外Q为氮氧化物且氮元素的化合价为+5价,则Q为五氧化二氮;R为含氮元素的另一种酸,且氮元素化合价为+3价,则R为亚硝酸。
(1)根据分析,A为氮气,D为氨气,氮气和氢气在高温、高压、催化剂的条件下生成氨气,化学方程式是N2+3H2 ![]() 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 ![]() 2NH3;
2NH3;
(2)根据分析,过程②中B为氮的氧化物,则发生的反应为氨气催化氧化反应生成一氧化氮和水,则E为一氧化氮,发生的反应方程式:4NH3+5O2 ![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(3)过程⑤为硝酸转化为二氧化氮,反应较多,如:浓硝酸与铜反应、硝酸受热分解或硝酸与碳单质反应都可产生二氧化氮,化学方程式为:Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O或者 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O或4HNO3(浓)
CO2↑+4NO2↑+2H2O或4HNO3(浓) ![]() 4NO2↑++O2↑+2H2O(任写一种),故答案为:Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O或者 C+4HNO3(浓)
4NO2↑++O2↑+2H2O(任写一种),故答案为:Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O或者 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O或者4HNO3(浓)
CO2↑+4NO2↑+2H2O或者4HNO3(浓) ![]() 4NO2↑++O2↑+2H2O(任写一种);
4NO2↑++O2↑+2H2O(任写一种);
(4)根据分析,R为亚硝酸,R可与 NaOH溶液反应:HNO2+NaOH=NaNO2+H2O,该反应中未发生化合价的变化,属于酸碱中和反应,体现了R(HNO2)的酸性,故答案为:酸;
(5)根据分析,Q为五氧化二氮,化学式是N2O5;Q属于酸性氧化物,也是硝酸的酸酐,五氧化二氮与水反应生成硝酸,化学方程式N2O5 +H2O=2HNO3,故答案为:N2O5+H2O=2HNO3;
(6)根据分析L为硝酸铵,为酸性后加入适量NaClO,可将L中阳离子转化为无污染气体以去除,则该无污染气体为氮气,硝酸铵与NaClO反应的离子方程式2NH4++3ClO-= N2↑+3Cl-+3H2O+2H+,故答案为:2NH4++3ClO-= N2↑+3Cl-+3H2O+2H+。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
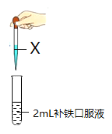
第三学期赢在暑假系列答案【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。