题目内容
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
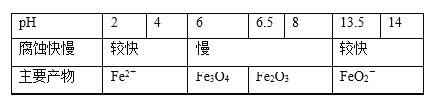
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=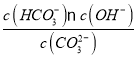 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“不变”)。
【答案】把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取少量待测液点在试纸的中部,变色后与标准比色卡对照读数 小于 等于 小于 > B c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) pH=10 1.8×10-8 不变
【解析】
(1)用pH试纸测定溶液的pH不能湿润;根据溶液中离子浓度对水电离平衡移动的影响分析比较溶液中水电离产生的离子浓度大小;
(2)溶液的导电性与溶液中微粒的浓度及离子带有的电荷数目有关,与微粒的种类无关;
醋酸是弱酸,在溶液中存在电离平衡,根据稀释对溶液中离子浓度的影响分析判断溶液的导电性;
(3)①根据人体血液的酸碱性确定碳酸氢根离子的电离和水解程度相对大小;
②发生酸中毒时,应该用碱性物质缓解;
③等浓度的Na2CO3和NaHCO3的混合,溶液由于水解而显碱性,根据物料守恒和两种盐的水解程度大小分析比较溶液中各离子浓度大小;
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=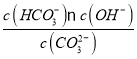 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,将数值带入,同时结合水的离子积常数及pH=-lgc(H+)溶液的pH;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,将数值带入,同时结合水的离子积常数及pH=-lgc(H+)溶液的pH;
(4)先根据AgNO3、NaCl溶液中溶质的物质的量,结合二者反应关系判断哪种物质过量,计算出过量离子的物质的量浓度,利用Ksp(AgCl)计算出c(Cl-),在溶液中存在沉淀溶解平衡,根据固体与溶解平衡关系分析判断离子浓度情况。
(1)pH试纸的使用方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取少量待测液点在试纸的中部,待变色后与标准比色卡对照读数;
0.1 mol/L NaOH溶液的pH=13,则c(OH-)=0.1mol/L;0.1 mol/LCH3COOH溶液的pH=3,则c(H+)=10-3mol/L,说明NaOH是一元强碱,醋酸是一元弱酸,等浓度的NaOH、CH3COOH溶液中离子浓度NaOH的大于醋酸的,由于在两种物质的溶液中都存在H2O的电离平衡:H2O![]() H++OH-,等浓度的H+、OH-对水的电离平衡抑制作用相同,由于等浓度的NaOH溶液中的离子浓度大于醋酸溶液中的离子浓度,所以对水的抑制作用NaOH>CH3COOH,故由水电离出的H+浓度c(H+)NaOH<c(H+)CH3COOH;
H++OH-,等浓度的H+、OH-对水的电离平衡抑制作用相同,由于等浓度的NaOH溶液中的离子浓度大于醋酸溶液中的离子浓度,所以对水的抑制作用NaOH>CH3COOH,故由水电离出的H+浓度c(H+)NaOH<c(H+)CH3COOH;
(2)溶液的导电性与溶液中微粒的浓度及离子带有的电荷数目有关,与微粒的种类无关。pH=3的CH3COOH溶液和HCl溶液各10mL,离子的浓度相等,离子所带电荷相同,所以溶液的导电能力也相等;
醋酸是一元弱酸,在溶液中存在电离平衡,c(CH3COOH)>c(H+),将两者10mL分别加水稀释到100 mL后,由于HCl是一元强酸,完全电离,稀释使溶液中离子浓度降低,而在CH3COOH溶液在存在电离平衡,稀释电离平衡正向移动,又使溶液中的离子浓度增大,最终达到平衡时,溶液中离子浓度CH3COOH溶液>HCl溶液,故稀释相同倍数后溶液的导电性:HCl<CH3COOH;
(3)①人体血液pH值保持在7.35~7.45之间,说明HCO3-的水解程度大于电离程度;
②发生酸中毒时,应用碱性物质缓解;
A.NaOH溶液是强碱溶液,具有强腐蚀性,不能使用,A不符合题意;
B.NaHCO3溶液水解显碱性,可以和酸反应起到缓解人体血液酸中毒,B符合题意;
C.NaCl溶液是中性溶液不起作用,C不符合题意;
D.Na2SO4溶液是中性溶液不能缓解血液的酸性,D不符合题意;
故合理选项是B;
③等浓度的Na2CO3和NaHCO3的混合,根据电解质的电离可知c(Na+)最大,由于Na2CO3和NaHCO3水解使溶液显碱性,所以c(OH-)>c(H+),水解程度CO32->HCO3-,则c(HCO3-)>c(CO32-),盐电离产生的离子浓度远大于水电离产生的H+、OH-的浓度,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故该混合溶液中各离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=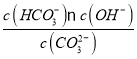 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,Kh=
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,Kh==2×c(OH-)=2×10-4 mol/L,所以c(OH-)=1×10-4 mol/L,c(H+)=10-10mol/L所以溶液的pH=10;
(4)1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01mol/L的NaCl溶液后,二者发生反应:Ag++Cl-=AgCl↓,根据反应关系可知:硝酸银过量,氯化钠完全反应,剩余的硝酸银浓度c(AgNO3)=c(Ag+)=![]() =0.01mol/L,根据AgCl的Ksp=1.8×10-10,可知c(Cl-)=
=0.01mol/L,根据AgCl的Ksp=1.8×10-10,可知c(Cl-)=![]() =1.8×10-8;反应后AgCl溶液形成沉淀溶解平衡体系,加入氯化银固体不影响平衡,因此溶液中氯离子浓度不变。
=1.8×10-8;反应后AgCl溶液形成沉淀溶解平衡体系,加入氯化银固体不影响平衡,因此溶液中氯离子浓度不变。

【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸