题目内容
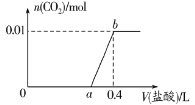
【题目】电解质溶液的电导率越大,导电能力越强。用浓度为0.100mol/L的NaOH溶液滴定10.00mL浓度均为![]() 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
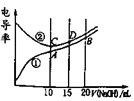
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol/L
C.在相同温度下,A、B、C三点溶液中水电离的c(H+)关系:B<A<C
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
【答案】C
【解析】
溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着KOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应时离子浓度最小,继续加入KOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1mol/L KOH溶液滴定HCl溶液的滴定曲线,曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,据此分析。
根据上述分析可知曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/L NaOH溶液滴定HCl溶液的滴定曲线。
A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,A正确;
B.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,B正确;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水电离的c(H+):B<C<A,故C错误;
D.D点溶液中,c(Na+)=1.5c(Cl-),溶液中电荷守恒为c(Cl-)+c(OH-)=c(Na+)+c(H+),则c(Cl-)=2 c(OH-)-2c(H+),D正确;
故合理选项是C。

 名校课堂系列答案
名校课堂系列答案【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。