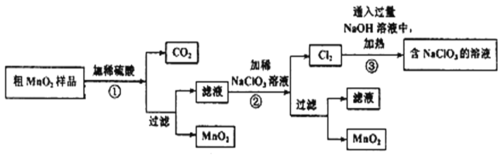
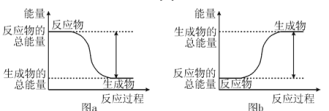
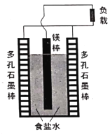
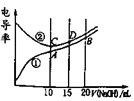
题目内容
【题目】取500mL Na2CO3溶液与300mL 1mol/L盐酸反应。在不断搅拌下,将Na2CO3溶液逐滴滴入盐酸中与将盐酸逐滴滴入Na2CO3溶液中,所产生气体的物质的量之比为3:2,则Na2CO3溶液的物质的量浓度为
A.0.4mol/LB.0.3mol/LC.0.2mol/LD.0.15mol/L
【答案】A
【解析】
将Na2CO3溶液滴入盐酸中,发生反应2HCl+Na2CO3=2NaCl+CO2↑+H2O;若将盐酸滴入Na2CO3溶液中,先发生反应:Na2CO3+HCl=NaHCO3+NaCl,再发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O;由于两个过程产生的CO2的物质的量之比为3:2,因此可以推出,第一个过程中,CO2的物质的量有HCl总物质的量决定,而第二个过程的CO2的物质的量由第二个反应的HCl的物质的量来决定。。
n(HCl)= 300mL×1mol/L=0.3mol,设500mL Na2CO3溶液中含x mol Na2CO3;经分析,第一个过程中HCl不足,则根据2HCl~CO2可得,生成CO2 0.15mol;在第二个过程中,根据第一个反应Na2CO3+HCl=NaHCO3+NaCl,可以推出生成的NaHCO3的物质的量为x mol,消耗HCl的物质的量为x mol,则参加第二个反应NaHCO3+HCl=NaCl+CO2↑+H2O的HCl的物质的量为(0.3-x)mol,则生成CO2的物质的量为(0.3-x)mol;则有![]() ,解得x=0.2mol,故c(Na2CO3)=
,解得x=0.2mol,故c(Na2CO3)=![]() =0.4mol/L,故选A。
=0.4mol/L,故选A。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案
相关题目