题目内容
5.(1)碳、氢气都是重要的燃料,请回答下列与碳、氢气相关的问题:①1mol固体碳和足量的氧气充分反应 生成二氧化碳,同时放出393.5kJ的热量,请写出该反应的热化学方程式:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol;
②已知2g H2(g)完全燃烧生成水蒸气时放出241.8kJ的热量,写出氢气与氧气完全反应生成水蒸气的热化学方程式:2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol; 若已知:H2O(g)═H2O(l)△H=-44kJ•mol-1,则氢气与氧气完全反应生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(1);△H=-571.6kJ/mol.
(2)水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,则 x为4,每生成1mol Fe3O4,被S2O32-还原的O2为0.5mol.
分析 (1)①据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
②根据反应物、生成物的状态、能量的变化写出热化学方程式,H2O(1)=H2O(g);△H=+44.0kJ/mol和(2)中的热化学方程式写出生成液态水的热化学方程式,然后根据方程式计算放出的能量;
(2)从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.
解答 解:(1)①1mol碳完全燃烧后可放出393.5KJ的热量,则该反应的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol;
故答案为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol;
②氢气、氧气、水蒸气的状态都是气态,燃烧后放出能量,所以△H<0;2g氢气的物质的量是1mol,1mol氢气燃烧后放出241.8kJ的热量,2mol氢气燃烧后放出483.6 kJ的能量,依据盖斯定律计算氢气与氧气完全反应生成水蒸气的热化学方程式:
2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol ①
H2O(1)=H2O(g);△H=+44.0kJ/mol ②
①-②×2得方程式:2H2(g)+O2(g)═2H2O(1);△H=-571.6kJ/mol
故答案为:2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol;2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol;
(2)反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,生成1mol Fe3O4,2molFe2+被氧化时,失去2mol电子,则被Fe2+还原的O2的物质的量为0.5mol,
故答案为:4;0.5.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用,氧化还原反应电子守恒、电荷守恒的分析计算,掌握基础是关键,题目难度中等.

| A. | 测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润 | |
| B. | 容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配制 | |
| C. | 用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 | |
| D. | 中和滴定时,锥形瓶需要用待测液润洗后才能使用 |
| A. | 3种和4种 | B. | 4种 和1种 | C. | 5种 和2种 | D. | 6种和4种 |
| A. | 某个氯原子的质量为ag,则氯元素的相对原子质量一定是aNA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 标准状况下,11.2LCCl4所含的原子总数为2.5NA | |
| D. | 10mL98%的浓H2SO4用水稀释至100mL,H2SO4的质量分数为9.8% |
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 升高温度 | 逆反应速率增大 量大于正反应速率增大量 | X的体积分数变大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定量Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | 分解反应和置换反应均属于氧化还原反应 |
 2-甲基丁烷;(2)
2-甲基丁烷;(2) 2,2-二甲基丙烷.
2,2-二甲基丙烷.
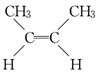 (顺式2-丁烯)、
(顺式2-丁烯)、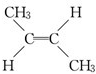 (反式2-丁烯);
(反式2-丁烯);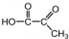 ,B.可与足量H2加成得到2-甲基戊烷,请写出B的结构简式CH3CH=CHC(CH3)=CHCH3;写出B发生加聚反应的方程式
,B.可与足量H2加成得到2-甲基戊烷,请写出B的结构简式CH3CH=CHC(CH3)=CHCH3;写出B发生加聚反应的方程式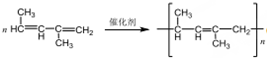 .
.