题目内容
6.25℃时,几种弱酸的电离常数如表:25℃时,下列说法正确的是( )| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
分析 A.电离平衡常数越大,酸性越强,电离程度越大,溶液的pH越高;
B.根据混合液中的电荷守恒判断;
C.等浓度时生成NaCN,CN-离子水解;
D.先计算氢氧根离子浓度,水电离出的氢离子浓度等于氢氧根离子浓度.
解答 解:A.由表格中的数据可知,醋酸电离平衡常数最大,酸性最强,则酸性越强,盐的水解越弱,所以等物质的量浓度溶液的pH关系为pH(Na2S)>pH(NaCN)>pH(CH3COONa),故A错误;
B.NaHS和Na2S的混合溶液中存在电荷守恒,所以一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故B正确;
C.等浓度时生成NaCN,CN-离子水解,则c(Na+)>c(CN-),所以a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN-),则a≤b,故C正确;
D.该溶液中c(OH-)=10d-14mol/L,水电离出的c(H+)=c(OH-)=10d-14mol/L,故D错误;
故选BC.
点评 本题离子浓度大小比较、弱电解质的电离平衡的应用,题目难度中等,试题综合性较强,根据表格中数据正确判断各酸的酸性强弱为解答关键,注意掌握判断离子浓度大小常用方法.

练习册系列答案
相关题目
17.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 某个氯原子的质量为ag,则氯元素的相对原子质量一定是aNA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 标准状况下,11.2LCCl4所含的原子总数为2.5NA | |
| D. | 10mL98%的浓H2SO4用水稀释至100mL,H2SO4的质量分数为9.8% |
14.将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s)?2Z(g);△H<0.当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 升高温度 | 逆反应速率增大 量大于正反应速率增大量 | X的体积分数变大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定量Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
1.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| C. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| D. | 由于W、Z元素的氢气化物还原性:W>Z |
15.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | 分解反应和置换反应均属于氧化还原反应 |
16.某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44.燃烧该有机物2.2g生成2.24L(标准状况下)CO2.下列说法不正确的是( )
| A. | 该有机物属于醛类 | |
| B. | 燃烧该有机物4.4 g,生成1.8g水 | |
| C. | 1 mol该有机物一定条件下能与l mol H2加成 | |
| D. | 0.01 mol该有机物与足量银氨溶液充分反应,析出金属银2.16 g |

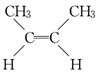 (顺式2-丁烯)、
(顺式2-丁烯)、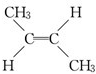 (反式2-丁烯);
(反式2-丁烯);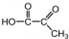 ,B.可与足量H2加成得到2-甲基戊烷,请写出B的结构简式CH3CH=CHC(CH3)=CHCH3;写出B发生加聚反应的方程式
,B.可与足量H2加成得到2-甲基戊烷,请写出B的结构简式CH3CH=CHC(CH3)=CHCH3;写出B发生加聚反应的方程式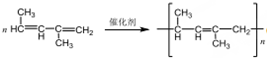 .
.